
【题目】成语、古诗词、谚语等都是我国传统文化的瑰宝。下列有关解读错误的是
选项 | 传统文化 | 化学角度解读 |
A | 兰陵美酒郁金香,玉碗盛来琥珀光 | “香”主要因为美酒含有酯类物质 |
B | “司南之杓(勺),投之于地,其柢(勺柄)指南” | 司南中“杓”的材质为Fe2O3 |
C | 三月打雷麦谷堆 | 在雷电作用下N2转化成能被作物吸收的氮元素 |
D | 《本草经集注》记载“如握盐雪不冰,强烧之,紫青烟起…云是真硝石也 | 利用物理方法(焰色反应)可以检验钠盐和钾盐 |
A.AB.BC.CD.D
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某铝合金中含有镁、铜、铝三种金属,现取10.0g 该铝合金,向其中加入100mL 3.0mol/L 氢氧化钠溶液,氢氧化钠溶液恰好完全反应,请计算:
(1)该铝合金中铝的质量分数________
(2)生成标准状况下的氢气的体积是_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】邮票被誉为国家名片,是我国化学史不可或缺的重要文献,下列说法错误的是( )

A.邮票甲中的人物是侯德榜,创立了中国人自己的制碱工艺—侯氏制碱法
B.邮票乙中的图是用橡胶生产的机动车轮胎,塑料、橡胶和纤维被称为三大合成材料
C.邮票丙中的图是显微镜下的结晶牛胰岛素,我国首次合成的结晶牛胰岛素属于蛋白质
D.邮票丁是纪念抗击非典的邮票,非典和新型冠状病毒都可用紫外线、高温等杀死
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究反应2X(g)=Y(g)+Z(g)的速率影响因素,在不同条件下进行4组实验,Y、Z起始浓度为0,反应物X的浓度( mol L-1)随反应时间(min)的变化情况如图所示。下列说法不正确的是
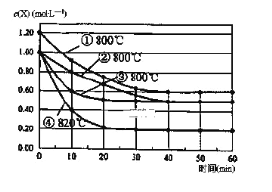
A.比较实验②、④得出:升高温度,化学反应速率加快
B.比较实验①、②得出:增大反应物浓度,化学反应速率加快
C.若实验②、③只有一个条件不同,则实验③使用了催化剂
D.在0~10min之间,实验②的平均速率v(Y)=0.04 molL-1min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某化学课外活动小组欲检验茶叶中铁元素,设计了如下实验方案:

请回答:
(1)操作①的名称是_____。
(2)加入6mol·L-1的盐酸时为了加快铁元素的浸出速度,可采取的方法有____、_____。
(3)通过血红色溶液不能说明茶叶中的铁元素一定是+3价的,原因是______。
Ⅱ.乙酸乙酯广泛用于药物、染料、香料等工业,甲乙两同学分别设计了如下装置来制备乙酸乙酯,已知:乙酸乙酯的沸点为77.1℃,CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O

(1)甲装置中右边导管未插入溶液中的目的是 ______。
(2)实验结束后分离出乙酸乙酯的操作是 ____,必须用到的玻璃仪器有____(选择)。
A.烧杯 B.容量瓶 C.分液漏斗 D.蒸馏烧瓶
(3)乙装置优于甲装置的理由____________(写两条)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA是阿伏加德罗常数的值。下列说法正确的是
A.0.5 mol N4(分子为正四面体结构)含共价键数目为2NA
B.锌与浓硫酸反应生成气体11.2 L(标准状况)时转移电子数目为NA
C.1 L 0.5 mol·L1 Na2S溶液中含阴离子数目小于0.5NA
D.14 g己烯和环己烷的混合物含氢原子数目为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化钼(MoO3)是石油工业中常用的催化剂,也是瓷轴药的颜料,该物质常使用辉钼矿(主要成分为MoS2)通过一定条件来制备。回答下列相关问题:
(1)已知:①MoS2(s)![]() Mo(s)+S2(g) △H1
Mo(s)+S2(g) △H1
②S2(g)+2O2(g)![]() 2SO2(g) △H2
2SO2(g) △H2
③2Mo(s)+3O2(g)![]() 2MoO3(s) △H3
2MoO3(s) △H3
则2MoS2(s)+7O2(g)![]() 2MoO3(s)+4SO2(g)的△H=___(用含△H1、△H2、△H3的代数式表示)。
2MoO3(s)+4SO2(g)的△H=___(用含△H1、△H2、△H3的代数式表示)。
(2)若在恒温恒容条件下,仅发生反应MoS2(s)![]() Mo(s)+S2(g)
Mo(s)+S2(g)
①下列说法正确的是___(填字母)。
a.气体的密度不变,则反应一定达到了平衡状态
b.气体的相对分子质量不变,反应不一定处于平衡状态
c.增加MoS2的量,平衡正向移动
②达到平衡时S2(g)的浓度为1.4molL-1,充入一定量的S2(g),反应再次达到平衡,S2(g)浓度____(填“>”“<”或“=”)1.4molL-1。
(3)在2L恒容密闭容器中充入1.0molS2(g)和1.5molO2(g),若仅发生反应:S2(g)+2O2(g)![]() 2SO2(g),5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,S2(g)的反应速率为____molL-1min-1。
2SO2(g),5min后反应达到平衡,此时容器压强为起始时的80%,则0~5min内,S2(g)的反应速率为____molL-1min-1。
(4)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应:2MoS2(s)+7O2(g)![]() 2MoO3(s)+4SO2(g) △H。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
2MoO3(s)+4SO2(g) △H。测得氧气的平衡转化率与起始压强、温度的关系如图所示。
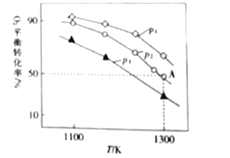
①△H____(填“>”“<”或“=”)0;比较p1、p2、p3的大小:___。
②若初始时通入7.0molO2,P2为7.0kPa,则A点平衡常数Kp=___(用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。压强为p1,温度为1100K时,平衡常数Kp′___(填“>”“<”或“=”)Kp。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由镁、铝、铁三种金属单质中的两种组成的混合物共6g,与足量的稀盐酸反应,产生标准状况下的氢气2.8L,由此得出的结论正确的是( )
A.该混合物中一定含有铝B.该混合物中一定含有铁
C.该混合物一定是由铁和镁组成的D.该混合物中一定不含铁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国是钢铁生产大国,也是铁矿石消费大国。某铁矿石主要成分为![]() 和
和![]() ,实验室为测定
,实验室为测定![]() 和
和![]() 的物质的量比,利用下图所示装置进行实验。
的物质的量比,利用下图所示装置进行实验。
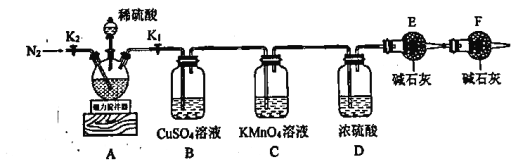
实验步骤如下:
Ⅰ.按图示连接仪器,检查装置气密性后加入药品;
Ⅱ.打开![]() 、
、![]() ,通入一段时间氮气,关闭
,通入一段时间氮气,关闭![]() 、
、![]() ,取下干燥管称量其质量(
,取下干燥管称量其质量(![]() )后再连接好装置;
)后再连接好装置;
Ⅲ.打开![]() 和分液漏斗活塞,向三颈烧瓶中慢慢滴加足量已经除去
和分液漏斗活塞,向三颈烧瓶中慢慢滴加足量已经除去![]() 的稀硫酸(其它杂质与稀硫酸不反应,且无还原性物质),待反应完成后,打开
的稀硫酸(其它杂质与稀硫酸不反应,且无还原性物质),待反应完成后,打开![]() 通入一段时间氮气;
通入一段时间氮气;
Ⅳ.关闭![]() 、
、![]() ,取下三颈烧瓶过滤、洗涤,将滤液与洗涤液合并成100mL溶液备用;
,取下三颈烧瓶过滤、洗涤,将滤液与洗涤液合并成100mL溶液备用;
Ⅴ.取下上述步骤ⅱ中的干燥管并称量其质量(![]() );
);
Ⅵ.取配制好的滤液25mL于锥形瓶中,用![]() 溶液滴定。
溶液滴定。
回答下列问题:
(1)步骤Ⅱ中需要称重的干燥管是_________(填“E”或“F”)。
(2)实验过程中发现B中有黑色沉淀生成,写出装置A中![]() 与稀硫酸反应的化学方程式__________________。
与稀硫酸反应的化学方程式__________________。
(3)C装置的作用是_________;若撤去装置F,则测得的![]() 的含量会_________(填“偏大”“偏小”或“无影响”)。
的含量会_________(填“偏大”“偏小”或“无影响”)。
(4)下列关于步骤Ⅳ的叙述正确的是_________(填标号)。
A.滤渣中含有还原产物单质硫
B.过滤过程中玻璃棒起到引流和搅拌的作用
C.过滤操作要迅速,否则会使测得的![]() 的含量偏低
的含量偏低
D.检验沉淀是否洗涤干净,可向滤液中加入氯化钡溶液,观察是否有白色沉淀生成
(5)步骤Ⅵ中发生反应的离子方程式为_________,到达滴定终点的现象是_________。
(6)若上述实验中![]() ,步骤Ⅵ消耗
,步骤Ⅵ消耗![]() 溶液45mL,则该矿石样品中
溶液45mL,则该矿石样品中![]() _________。
_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com