
【题目】Ⅰ.“一酸两浸,两碱联合”法是实现粉煤灰(含SiO2、Al2O3、Fe2O3、CaO、MgO等)综合利用的新工艺。聚合氯化铝铁(PAFC)化学式为:[Al2(OH)nCl6-n]m·[Fe2(OH)xCl6-x]y,是一种新型高效的净水剂。工业流程如下:

回答下列问题:
(1)实际工业中“酸浸”、“碱浸”均不能充分反应,滤渣A中主要含有SiO2、Al2O3。“纯碱混合焙烧”中,它们分别发生反应的化学方程式为_________________、_________________。
(2)滤液混合后“蒸发”的作用是________________________________。
(3)“电解”时阳极的电极反应式为________________。
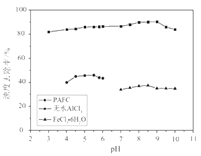
(4)PAFC、无水AlCl3、FeCl3·6H2O用量均为25 mg·L-1时,处理不同pH污水的浊度去除率如图所示,PAFC的优点是___________________________。
Ⅱ.(5)25℃时,用0.1mol/L的CH3COOH溶液滴定20mL0.1mol/L的NaOH溶液,当滴加VmLCH3COOH溶液时,混合溶液的pH=7。已知CH3COOH的电离平衡常数为Ka,忽略混合时溶液体积的变化,Ka的表达式为___________。
(6)常温下,测得某纯CaSO3与水形成的浊液pH为9,已知Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9,忽略SO32-的第二步水解,则Ksp(CaSO3)=_________________。
【答案】 Na2CO3+SiO2![]() Na2SiO3+CO2↑ Na2CO3+Al2O3
Na2SiO3+CO2↑ Na2CO3+Al2O3![]() 2NaAlO2+CO2↑ 促进Al3+、Fe3+水解生成了聚合氯化铝铁(PAFC) 2Cl--2e-=Cl2↑ 聚合氯化铝铁(PAFC)净水效率高,pH适用范围广 Ka=
2NaAlO2+CO2↑ 促进Al3+、Fe3+水解生成了聚合氯化铝铁(PAFC) 2Cl--2e-=Cl2↑ 聚合氯化铝铁(PAFC)净水效率高,pH适用范围广 Ka=![]() 4.2×10-9
4.2×10-9
【解析】(1)滤渣A中主要含有SiO2、Al2O3。“纯碱混合焙烧”后,再次酸浸,烘干得到SiO2,故纯碱混合焙烧后,生成Na2SiO3,它们分别发生反应的化学方程式为Na2CO3+SiO2![]() Na2SiO3+CO2↑ 、Na2CO3+Al2O3
Na2SiO3+CO2↑ 、Na2CO3+Al2O3![]() 2NaAlO2+CO2↑ ;
2NaAlO2+CO2↑ ;
(2滤液中有Al3+、Fe3+,混合后“蒸发”得到[Al2(OH)nCl6-n]m·[Fe2(OH)xCl6-x]y,故其作用是促进Al3+、Fe3+水解生成了聚合氯化铝铁(PAFC);
(3)电解氯化钠溶液,阳极反应式为:2Cl--2e-=Cl2↑;
(4)PAFC、无水AlCl3、FeCl3·6H2O用量均为25 mg·L-1时,处理不同pH污水的浊度去除率图中,PAFC曲线pH适用范围广,净水效率高;
Ⅱ.(5) 当滴加VmLCH3COOH溶液时,混合溶液的pH=7,此时氢离子和氢氧根离子浓度相等,都是10-7mol/L,根据电荷守恒,钠离子浓度等于醋酸根离子浓度,c(Na+)=![]() ,CH3COOH的电离平衡常数为Ka=
,CH3COOH的电离平衡常数为Ka=![]() -7
-7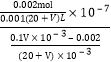 =
=![]() ;
;
(6) 由Ka2(H2SO3)=6.0×10-9可知SO32-+H2OHSO3-+OH-的水解Kh=![]() =1.67×10-4,常温下,测得某纯CaSO3与水形成的浊液pH为9,c(HSO3-)=c(OH-)=1×10-5,可知c(SO32-)=
=1.67×10-4,常温下,测得某纯CaSO3与水形成的浊液pH为9,c(HSO3-)=c(OH-)=1×10-5,可知c(SO32-)=![]() =6×10-5,又c(Ca2+)=c(SO32-)+c(HSO3-)=7×10-5,Ksp(CaSO3)=c(Ca2+)×c(SO32-)=7×10-5×6×10-5=4.2×10-9。
=6×10-5,又c(Ca2+)=c(SO32-)+c(HSO3-)=7×10-5,Ksp(CaSO3)=c(Ca2+)×c(SO32-)=7×10-5×6×10-5=4.2×10-9。


 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示.则下列说法正确的是( ) 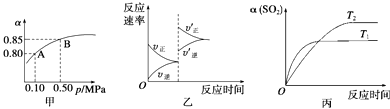
A.由图甲知,A点SO2的平衡浓度为0.4 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是人类最理想的能源。已知在25℃、101 kPa下,1 g 氢气完全燃烧生成液态水时放出热量142.9 kJ,则下列热化学方程式书写正确的是( )
A.2H2+O2=2H2O ΔH=-142.9 kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l)ΔH=-142.9 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l)ΔH=-571.6 kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l)ΔH=+571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雷雨天闪电时空气中有臭氧(O3)生成.下列说法正确的是( )
A.O2和O3互为同位素
B.O2和O3的相互转化是物理变化
C.在相同的温度与压强下,等体积的O2和O3含有相同的分子数
D.等物质的量的O2和O3含有相同的质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA(s)+bB(g)cC(g)+dD(g)进行过程中,当其他条件不变时,C的体积分数C%与温度(T)、压强(P)的关系如图所示.下列叙述正确的是( ) 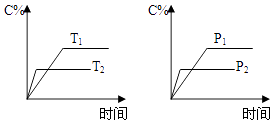
A.达到平衡后,加入催化剂,C的体积分数增大
B.达到平衡后,升高温度,平衡向左移动
C.化学方程式中,b>c+d
D.达到平衡后,增加A的量,平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第四周期的元素,如:钛(22Ti)、铁(26Fe)、砷、硒、锌等及其相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)基态Ti原子中,最高能层电子的电子云轮廓形状为___________,与Ti同周期的所有过渡元素的基态原子中,最外层电子数与钛不同的元素有______种。
(2)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+ 易被氧化成Fe3+的原因是______________。
(3)SCN-离子可用于Fe3+的检验,其对应的酸有两种,分别为硫氰酸(H-S-C≡N)和异硫氰酸(H-N=C=S)。
①写出与SCN-互为等电子体的一种微粒_________________(分子或离子);
②硫氰酸分子中π键和σ键的个数之比为___________;
③异硫氰酸的沸点比硫氰酸沸点高的原因是________________________。
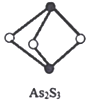
(4)成语“信口雌黄”中的雌黄分子式为As2S3,分子结构如图,As原子的杂化方式为____________,雌黄和SnCl2在盐酸中反应转化为雌黄(As4S4)和SnCl4并放出H2S气体,写出该反应方程式__________________________。SnCl4分子的空间构型为______________。
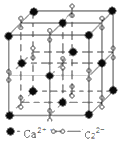
(5)高子化合物CaC2的一种晶体结构如图所示。该物质的电子式___________。一个晶胞含有的π键平均有___________个。
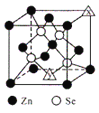
(6)硒化锌的晶胞结构如图所示,图中X和Y点所堆积的原子均为___________(填元素符号);该晶胞中硒原子所处空隙类型为___________(填“立方体”、“正四面体”或正八面体”),该种空隙的填充率为___________;若该晶胞密度为pgcm-3,硒化锌的摩尔质量为Mgmol-1。用NA代表阿伏加德罗常数的数值,则晶胞参数a 为___________nm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A(C4H10O)是一种有机溶剂.A可以发生以下变化: 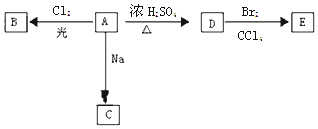
(1)A分子中的官能团名称是 .
(2)若A只有一种一氯取代物B.写出由D转化为E的化学方程式: .
(3)若A的同分异构体F也可以有框图内A的各种变化,且F的一氯取代物有三种. 则F的结构简式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化还原反应的说法正确的是
A.氧化还原反应的实质是电子的转移
B.置换反应不一定是氧化还原反应
C.还原剂被氧化,发生还原反应
D.化合反应不可能是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应 Cu(s)+2Ag+(aq) == Cu2+(aq)+2Ag(s)设计成如图所示原电池。下列说法中正确的是( )

A. 电极X是正极,其电极反应为Cu-2e-== Cu2+
B. 银电极板质量逐渐减小,Y溶液中c(Ag+)增大
C. 当X电极质量变化0.64 g时,Y溶液质量变化2.16 g
D. 外电路中电流由银极流向铜极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com