
【题目】下列操作或现象正确的是
①对二次电池进行充电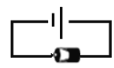
②验证Na2O2溶于水的热效应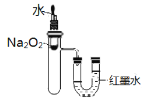
③中和热的测定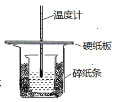
④金属铁的腐蚀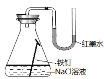
A.②④B.①②③C.①④D.①②③④
 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案科目:高中化学 来源: 题型:
【题目】I.氧化铁是一种重要的无机材料,化学性质稳定,催化活性高,具有良好的耐光性、耐热性和对紫外线的屏蔽性,从某种酸性工业废液(主要含Na+、Fe2+、Fe3+、Mg2+、Al3+、Cl-、SO42-)中回收氧化铁的流程如图所示:
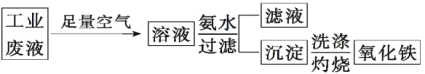
已知:常温下Ksp[Mg(OH)2]=1.2×10-11、Ksp[Fe(OH)2]=2.2×10-16、Ksp[Fe(OH)3]=3.5×10-38、Ksp[Al(OH)3]=1.0×10-33。
(1)写出在该酸性废液中通入空气时发生的反应的离子方程式:_________________,使用空气的优点是_____。
(2)常温下,在pH=5的溶液中Fe3+存在的最大浓度为_____。
(3)有人利用氨水调节溶液pH,在pH=5时将Fe(OH)3沉淀出来,此时可能混有的杂质是_____(填化学式,下同),用_____试剂可将其除去。
II.某研究性学习小组为探究Fe3+与Ag反应,进行如下实验:按下图连接装置并加入药品(盐桥中的物质不参与反应)。
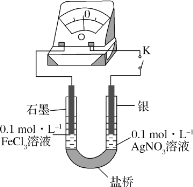
(4)K闭合时,指针向左偏转,石墨作____(填“正极”或“负极”)。
(5)当指针归零后,向左侧U形管中滴加几滴FeCl2浓溶液,发现指针向右偏转,写出此时银电极的反应式:_____。
(6)结合上述实验分析,写出Fe3+和Ag反应的离子方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a.  b.
b.  c.
c.  d.
d. 
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请把符合要求的化学方程式的编号填在下列空白处:
①既属于分解反应又是氧化还原反应的是________。
②属于化合反应,但不是氧化还原反应的是________。
③既属于化合反应,又是氧化还原反应的是________。
④属于分解反应,但不是氧化还原反应的是________。
⑤不属于四种基本反应类型的氧化还原反应的是________。
A.2NaHCO3![]() Na2CO3+H2O+CO2↑
Na2CO3+H2O+CO2↑
B.2Na+Cl2![]() 2NaCl
2NaCl
C.Zn+CuSO4===ZnSO4+Cu
D.2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
E.CaO+CO2===CaCO3
F.4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
(2)根据反应Cu+4HNO3(浓)===Cu(NO3)2+2NO2↑+2H2O,回答下列问题:
①还原剂是________,还原产物是________。
②氧化剂与氧化产物的物质的量比是________。
③当有2 mol HNO3参加反应时,被氧化的物质质量为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是国际化学界统一规定的用来表示物质的组成、结构和变化规律的特殊符号,同时也是学习化学的一种专用工具。下列有关化学用语正确的是( )
A.NH4Cl中Cl的结构示意图:![]()
B.质子数为17、中子数为20的氯原子:![]()
C.新制氯水中会有少量次氯酸,其电子式为:![]()
D.明矾可用于净水,其化学式为:KAl(SO4)2 12H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应:3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是

A. 若t1=15s, A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.09 mol·L-1·s-1
B. t0~t1阶段,此过程中容器放出a kJ热量,该反应的热化学方程式为:3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
C. 该容器的容积为2 L,B的起始的物质的量为0.03 mol
D. t1时该反应达到平衡且A 的转化率为60%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氨气代替氢气研发氨燃料电池是当前科研的热点。如图是两种氨燃料电池,下列说法正确的是
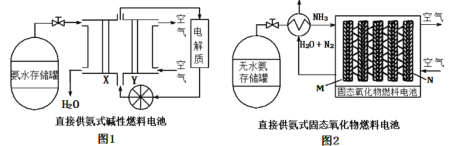
A.随着反应的进行,两个装置中电解质不断减少,需及时补充电解质
B.工作时,图1中OH-移向Y极
C.两个原电池中均生成1molN2时,移动到负极的阴离子均为6mol
D.两个装置中负极的电极反应式不同,图2的为2NH3+3O2--6e-=N2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:
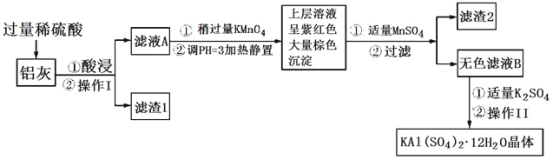
回答下列问题:
(1)明矾净水的原理是___(用离子方程式表示)。
(2)操作Ⅰ是___,操作Ⅱ是蒸发浓缩、___、过滤、___、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是___(只用一种试剂)。
(4)在滤液A中加入高锰酸钾的作用:___。
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:___,滤渣2含有的物质是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与人类生产、生活密切相关。下列有关说法不正确的是
A. 在燃煤中加生石灰以减少含硫化合物排放
B. 天然气运输时应悬挂如图所示的标志
C. 面粉生产车间应严禁烟火
D. 金属钠着火时使用泡沫灭火器或水灭火
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com