
【题目】以氨气代替氢气研发氨燃料电池是当前科研的热点。如图是两种氨燃料电池,下列说法正确的是
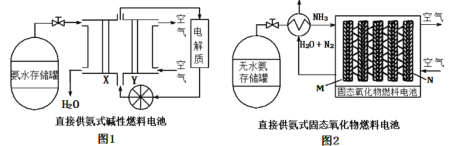
A.随着反应的进行,两个装置中电解质不断减少,需及时补充电解质
B.工作时,图1中OH-移向Y极
C.两个原电池中均生成1molN2时,移动到负极的阴离子均为6mol
D.两个装置中负极的电极反应式不同,图2的为2NH3+3O2--6e-=N2+3H2O
【答案】D
【解析】
以氨气代替氢气研发的氨燃料电池,不论电解质是什么物质,电池反应的产物均为氮气和水。
A. 氨气的氧化产物是氮气和水,产物不与电解质反应,故随着反应的进行,两个装置中电解质不会减少,不需补充电解质,A不正确;
B. 工作时,图1中X为负极,OH-移向X极,B不正确;
C. 两个原电池中均生成1molN2时,图1中移动到负极的阴离子(OH-)为6mol,图2中移动到负极的阴离子(O2-)为3mol,C不正确;
D. 两个装置中负极的电极反应式不同,图1中的负极的电极反应式为2NH3+6OH--6e-=N2+6H2O,图2的为2NH3+3O2--6e-=N2+3H2O,D正确。
综上所述,相关说法正确的是D。


科目:高中化学 来源: 题型:
【题目】下表是某城市某日空气质量报告:
污染指数 | 首要污染物 | 空气质量级别 | 空气质量状况 |
55 | SO2 | II | 良 |
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行探究。
实验一:用下图所示装置进行实验。
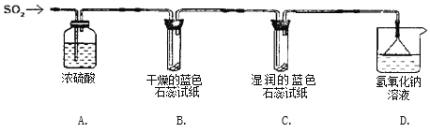
(1)A装置的作用是_________(填“干燥”或“氧化”)SO2气体。
(2)实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变_______色(填“蓝色”或“红色”或“不变色”),说明SO2与水反应生成一种酸。
(3)D装置的作用是______________,并写出化学反应方程式_____________________________。
实验二:往盛有水的烧杯中通入SO2气体,测得所得溶液的pH_______7(填“>”“=”或“<”),然后每隔1 h测定其pH,发现pH逐渐变小,直至恒定。说明烧杯中溶液被空气中的氧气氧化最终生成H2SO4。
(查阅资料) SO2形成酸雨的另一途径:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4。在此过程中飘尘作_________(填“催化剂”或“氧化剂”)。
(探究结论)SO2与空气中的氧气、水反应生成硫酸形成酸雨。该市可能易出现酸雨(知识联想)
(1)酸雨造成的危害是:______________________________(举一例)。
(2)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为____________,是造成酸雨的另一主要原因。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)![]() B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g)+C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
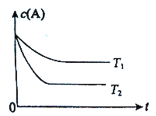
(1)上述反应是______________(填”吸热反应”或”放热反应”),温度T1_____T2,(填“大于”、“小于”或“等于”,下同)平衡常数K(T1)_______K(T2)。
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%,则:
①平衡时体系总的物质的量为___________。
②反应在0~5min区间的平均反应速率v(A)=____________。
(3)在温度T1时,若增大体系压强,A的转化率_________(填“增大”、“减小”或“不变”,下同),平衡常数________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)、C2H4(g)和C2H5OH(1)的燃烧热分别是-285.8kJ·mol-1、-1411.0kJ·mol-1和-1366.8kJ·mol-1,则由C2H4(g)和H2O(l)反应生成C2H5OH(l)的△H为( )
A. -44.2kJ·mol-1 B. +44.2kJ·mlo-1
C. -330kJ·mol-1 D. +330kJ·mlo-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲酸甲酯是重要有机化工原料,制备反应为CH3OH(g)+CO(g) ![]() HCOOCH3(g) ΔH<0;相同时间内,在容积固定的密闭容器中,使反应在不同温度下进行(起始投料比均
HCOOCH3(g) ΔH<0;相同时间内,在容积固定的密闭容器中,使反应在不同温度下进行(起始投料比均![]() 为1),相同时间内测得CO的转化率随温度变化的曲线如下图。下列说法中不正确的是
为1),相同时间内测得CO的转化率随温度变化的曲线如下图。下列说法中不正确的是
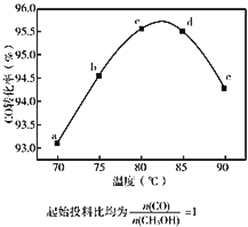
A. 70~80℃,CO转化率随温度升高而增大,其原因是升高温度反应速率增大
B. 85~90℃,CO转化率随温度升高而降低,其原因可能是升高温度平衡逆向移动
C. d点和e点的平衡常数:Kd < Ke
D. a点对应的CO的转化率与CH3OH的转化率相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了证明稀硝酸与铜反应的气体产物是![]() ,某同学设计了如下实验。
,某同学设计了如下实验。
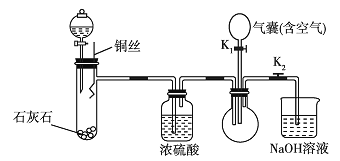
(1)关闭![]() ,打开
,打开![]() ,通过分液漏斗向石灰石中加入稀硝酸,则石灰石的作用是__________,反应的化学方程式是_______。
,通过分液漏斗向石灰石中加入稀硝酸,则石灰石的作用是__________,反应的化学方程式是_______。
(2)将铜丝插入稀硝酸中,充分反应后,打开![]() ,通过气囊鼓人空气,可以观察到烧瓶中______,证明稀硝酸与铜反应的气体产物是
,通过气囊鼓人空气,可以观察到烧瓶中______,证明稀硝酸与铜反应的气体产物是![]() 。
。
(3)铜与稀硝酸反应的离子方程式为___________。
(4)![]() 溶液的作用是_________。
溶液的作用是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2SO4在一定条件下发生如下反应:4(NH4)2SO4![]() N2↑+6 NH3↑+3SO2↑+SO3↑+7H2O 将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是
N2↑+6 NH3↑+3SO2↑+SO3↑+7H2O 将反应后的气体通入一定量的BaCl2溶液中,发现溶液有白色沉淀生成,还有部分气体从溶液中逸出,检验发现从溶液中逸出的气体无色、无味,溶液中氯化钡恰好完全反应。下列说法正确的是
A.生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:1
B.生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:2
C.生成沉淀中既有BaSO4、又有BaSO3,且n(BaSO4):n(BaSO3)约为1:3
D.从溶液中逸出的气体只有N2,最后留下溶液中溶质只有较多的NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象预测正确的是( )
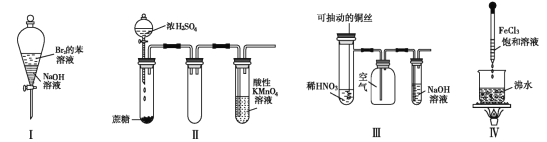
A. 实验Ⅰ:振荡后静置,上层溶液颜色保持不变
B. 实验Ⅱ :酸性 KMnO4 溶液中出现气泡,且颜色逐渐褪去
C. 实验Ⅲ:微热稀 HNO3 片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验Ⅳ:滴入 FeCl3 后,可形成带电的胶体,该分散系导电能力增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com