
【题目】Cl2和SO2都具有漂白作用,能使品红溶液褪色。若将等物质的量的Cl2、SO2混合后再通入品红与BaCl2的混合溶液,能观察到的现象是( )
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
A.①②B.①③C.②③D.②④
 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是( ) ①1mol O2的质量是32gmol﹣1;②H2的摩尔质量是2g;③1mol H+的质量是1g;④对原子而言,摩尔质量就是相对原子质量.
A.①②③
B.③④
C.③
D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种二元弱酸,可用作还原剂、络合剂、掩蔽剂、沉淀剂。某校课外小组的同学设计利用C2H2气体制取H2C2O4·2H2O。
回答下列问题:
(1)甲组的同学利用电石(主要成分CaC2,少量CaS及Ca3P2等)并用下图装置制取C2H2[反应原理为:CaC2+2H2O![]() Ca(OH)2+C2H2(g) △H<0,反应剧烈]:
Ca(OH)2+C2H2(g) △H<0,反应剧烈]:
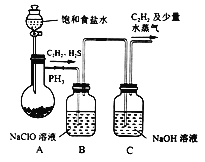
① 装置A用饱和食盐水代替水并缓慢滴入烧瓶中,其目的是__________。
② 装置B中,NaClO将H2S、PH3氧化为硫酸及磷酸,本身还原为NaCl,其中H2S被氧化的离子方程式为________。
(2)乙组的同学根据文献资料,用Hg(NO3)2作催化剂,浓硝酸氧化乙炔制取H2C2O4·2H2O。制备装置如下:
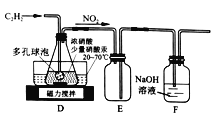
①装置D多孔球泡的作用是_________;装置E的作用是________。
②D中生成H2C2O4的化学方程式为_______。
③从装置D得到产品,还需经过浓缩结晶、________(填操作名称)洗涤及干燥。
(3)丙组设计了测定乙组产品在H2C2O4·2H2O的质量分数实验。他们的实验步骤如下:精确称取m g产品于锥形瓶中,加入适量的蒸馏水溶解,在加入少量稀硫酸,然后用cmol/L酸性KMnO4标准溶液进入滴定,滴至溶液显微红色;共消耗标准溶液VmL。
①滴定时,KMnO4标准溶液盛放在__________滴定管中(填“酸式”或“碱式”)。
②滴定时KMnO4被还原Mn2+,其反应的离子方程式为_____,滴定过程中发现褪色速率先慢后逐渐加快,其主要原因是__________。
③产品中H2C2O4·2H2O的质量分数为_________(列出含m、c、v的表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
①1L0.1mol/LNH4NO3溶液中氮原子数小于0.2NA
②用标准盐酸滴定NaOH溶液测其浓度时,酸式滴定管用蒸馏水洗涤后,没用标准盐酸润洗,直接装标准盐酸滴定,所测的碱液浓度偏低
③pH相等的四种溶液:a.CH3COONa b.C6H5ONa c.NaHCO3d.NaOH。(已知酸性:C6H5OH<H2CO3)其溶液物质的量浓度由小到大顺序为:d 、b 、c 、a
④钢铁腐蚀时可能发生的正极反应:2H2O+O2+4e-=4OH-
⑤电解饱和MgCl2溶液时,电解反应式为:2H2O+2Cl-![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
⑥在海轮外壳连接锌块保护外壳不受腐蚀是采用牺牲阳极的阴极保护法
⑦长期使用硫酸铵,土壤酸性增强:草木灰与铵态氮肥不能混合施用
A. ①②⑤⑥ B. ①③⑤⑦ C. ③④⑥⑦ D. ②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
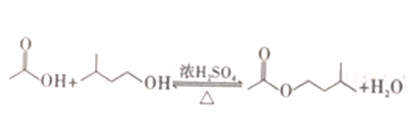
【题目】工业上用过量的乙酸和异成醇制备乙酸异戊酯,原理(如图所示) 和有关数据如下:
物质 | 相对分子质量 | 密度/(g·cm-3) | 熔点/℃ | 沸点/℃ | 水中溶解度 |
异戊醇 | 88 | 0.8123 | -117 | 131 | 微溶 |
乙酸 | 60 | 1.0492 | 17 | 118 | 溶 |
乙酸异戊酯 | 130 | 0.8670 | -78 | 142 | 难溶 |
下列说法正确的是
A. 常温下,可用过滤的方法分离乙酸异戊酯和水溶液
B. 反应中,加入过量的乙酸的主要目的是加快该反应的反应速率
C. 为了除去产物中混有的乙酸,可以向混合物中加入足量饱和Na2CO3溶液,充分振荡后静置、分液
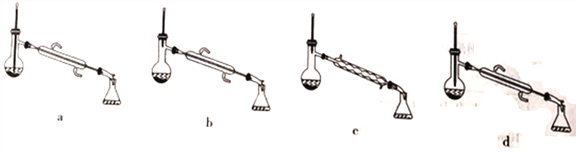
D. 为了除去产物中混有的异戊醇,应选择如图所示装置中的c装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应aA(g)+bB(g)![]() cC(g)△H="Q" 在密闭容器中进行,在不同温度(T1和T2)及压强(P1和P2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )
cC(g)△H="Q" 在密闭容器中进行,在不同温度(T1和T2)及压强(P1和P2)下,混合气体中B的质量分数w(B)与反应时间(t)的关系如图所示,下列判断正确的是( )

A. T1<T2,P1<P2,a+b>c,Q<0
B. T1>T2,P1<P2,a+b<c,Q>0
C. T1<T2,P1>P2,a+b<c,Q>0
D. T1<T2,P1>P2,a+b>c,Q<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热稳定系数和总氯量是漂白粉行业标准里的两个指标。
Ⅰ.利用如图装置(省略加热装置),探究漂白粉的热分解产物。资料显示:久置于潮湿环境中的漂白粉受热生成的气体产物有O2和少量Cl2。

(1)加热干燥漂白粉样品,观察到B中有大量无色气泡产生。则次氯酸钙分解的固体产物中一定有________。
(2)加热久置于潮湿环境中的漂白粉样品,观察到B中也有气泡产生。
①B中发生反应的离子方程式为_______。
②待充分反应后,断开连接A、B的橡皮管,停止加热,冷却。利用B中产物,通过实验证明加热时有少量氯气生成。请设计实验方案:_________。
Ⅱ. 测定漂白粉总氯的百分含量(即样品中氯元素总质量与样品总质量的比值)。实验步骤如下:
①准确称取5.000 g漂白粉样品,研细,加蒸馏水溶解并冷却后,稀释至500 mL。
②移取25.00 mL该试样溶液至锥形瓶中,调节pH,缓慢加入适量3% H2O2水溶液,搅拌至不再产生气泡。加入适量K2CrO4溶液作为指示剂,以0.1000mol/L AgNO3标准溶液滴定至终点。多次实验,测得消耗AgNO3标准溶液平均体积为25.00 mL。(已知:Ksp(AgCl,白色)=1.56×10-10,Ksp(Ag2Cr2O4,砖红色)=9.0×10-12)
(3)步骤①中,溶解、稀释的过程所用的玻璃仪器有烧杯、玻璃棒、____、 ____。
(4)加入H2O2水溶液,搅拌至不再产生气泡,目的是______(用离子方程式表示)。
(5)滴定终点的现象是_______。
(6)该漂白粉总氯的百分含量为__________。
(7)下列操作导致总氯百分含量测定结果偏高的是______。
A.指示剂K2CrO4的用量过多
B.在滴定终点读取滴定管刻度时,俯视标准液液面
C.滴定前滴定管尖嘴部分有气泡,滴定后消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. CaCO3+2HCl=CaCl2+CO2↑ + H2O
B. CaO+H2O=Ca(OH)2
C. CaCO3![]() CaO+CO2↑
CaO+CO2↑
D. 3Cu+8HNO3(稀) = 3Cu(NO3)2+2NO↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com