
【题目】下列说法正确的是( ) ①1mol O2的质量是32gmol﹣1;②H2的摩尔质量是2g;③1mol H+的质量是1g;④对原子而言,摩尔质量就是相对原子质量.
A.①②③
B.③④
C.③
D.②④
科目:高中化学 来源: 题型:
【题目】下列物质中既能与稀H2SO4反应,又能与NaOH溶液反应的是①Al2O3②NaHSO4③NaHCO3④Al(OH)3⑤Na2CO3( )
A.①③④B.②③⑤C.②④⑤D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢能是发展中的新能源,它的利用包括氢的制备、储存和应用三个环节。回答下列问题:
(1)与汽油相比,氢气作为燃料有许多优点,但是氢气直接燃烧的能量转换率远低于燃料电池,写出碱性氢氧燃料电池的负极反应式:________________________________。
(2)氢气可用于制备H2O2。
已知:H2(g)+A(l)===B(l) ΔH1
O2(g)+B(l)===A(l)+H2O2(l) ΔH2
其中A、B为有机物,两反应均为自发反应,则H2(g)+O2(g)===H2O2(l)的ΔH________0(填“>”“<”或“=”)。
(3)在恒温恒容的密闭容器中,某储氢反应:MHx(s)+yH2(g) ![]() MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
MHx+2y(s) ΔH<0达到化学平衡。下列有关叙述正确的是________。
a.容器内气体压强保持不变 b.吸收y mol H2只需1 mol MHx
c.若降温,该反应的平衡常数增大 d.若向容器内通入少量氢气,则v(放氢)>v(吸氢)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示。回答下列问题:
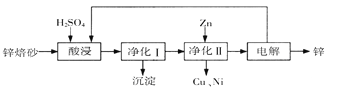
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为
(2)净化I操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式
②250C时,pH=3的溶液中,c (Fe3+)= mol/L(已知25℃,![]() 。
。
③净化I生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是 。
(3)若没有净化II操作,则对锌的制备带来的影响是 。
(4)本流程中可以循环利用的物质除锌外还有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度、压强下,1体积X2(气)和3体积Y2(气)化合成2体积的气体化合物,则该气体化合物的化合式为( )
A.XY3
B.XY
C.X3Y
D.X2Y3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍镉(Ni—Cd)可充电电池在现代生活中,有广泛应用,它的工作原理如下:Cd+2NiO(OH)+2H2O ![]() Cd(OH)2+2Ni(OH)2.下列叙述正确的是
Cd(OH)2+2Ni(OH)2.下列叙述正确的是
A. 该电池放电的时候,负极附近pH增大
B. 放电时每转移2mol电子,有2mol NiO(OH)被氧化
C. 充电时,阳极反应式是Ni(OH)2-e-+OH-=NiO(OH)+H2O
D. 充电时,Cd电极接电源正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下某容积不变的密闭容器中,可逆反应C(s)+H2O(g)![]() CO(g)+H2(g)可建立平衡状态。下列状态中不能确定该反应已达到平衡状态的是( )
CO(g)+H2(g)可建立平衡状态。下列状态中不能确定该反应已达到平衡状态的是( )
A. 体系的压强不再发生变化 B. v正(CO)=v逆(H2O)
C. 生成n mol CO的同时生成n mol H2 D. 1 mol H—H键断裂的同时断裂2 mol H-O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容量瓶是用来配制物质的量浓度的溶液的定量仪器,其上标有:①温度 ②浓度 ③容量 ④压强⑤刻度线 ⑥酸式或碱式这六项中的( )
A.②④⑥
B.③⑤⑥
C.①②④
D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cl2和SO2都具有漂白作用,能使品红溶液褪色。若将等物质的量的Cl2、SO2混合后再通入品红与BaCl2的混合溶液,能观察到的现象是( )
①溶液很快褪色 ②溶液不褪色 ③出现沉淀 ④不出现沉淀
A.①②B.①③C.②③D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com