
【题目】设![]() 为阿伏加德罗常数的值,下列说法正确的是( )
为阿伏加德罗常数的值,下列说法正确的是( )
A.常温常压下,![]() 与
与![]() 的混合气体中含有分子总数为
的混合气体中含有分子总数为![]()
B.![]() 羟基
羟基![]() -OH
-OH![]() 和1mol甲基
和1mol甲基![]() -CH3
-CH3![]() 中含有的电子数均为
中含有的电子数均为![]()
C.a mol苯乙烯![]()
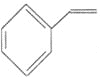
![]() 中含有C-H键的数目为
中含有C-H键的数目为![]()
D.![]() 与浓硫酸完全反应,生成气体的分子数为
与浓硫酸完全反应,生成气体的分子数为![]()
【答案】D
【解析】
A.![]() 与
与![]() 摩尔质量相同,混合气体的摩尔质量为
摩尔质量相同,混合气体的摩尔质量为![]() ,
,![]() 混合气体的物质的量n=
混合气体的物质的量n= ![]() =
=![]() =
=![]() ,则混合气体的分子总数为
,则混合气体的分子总数为![]() ,故A错误;
,故A错误;
B.一个羟基和一个甲基都含有9个电子,1mol羟基![]() 和1mol甲基
和1mol甲基![]() 中含有的电子的物质的量为9mol,电子数均为
中含有的电子的物质的量为9mol,电子数均为![]() ,故B错误;
,故B错误;
C.苯乙烯结构中苯环上也有![]() 键,一个苯乙烯分子含有8个C—H键,
键,一个苯乙烯分子含有8个C—H键,![]() 苯乙烯中含有
苯乙烯中含有![]() 键的数目为
键的数目为![]() ,故C错误;
,故C错误;
D.![]() 的物质的量n=
的物质的量n=![]() =
=![]() =
=![]() ,Mg的化合价从0价升高到+2价,镁与浓硫酸反应为Mg+2H2SO4(浓)= MgSO4+2H2O+SO2↑,浓硫酸反应到后期形成了稀硫酸,镁与稀硫酸反应为Mg+H2SO4= MgSO4+H2↑,无论是生成氢气,还是生成二氧化硫,都是1molMg生成1mol气体,则0.1mol镁生成气体的物质的量为0.1mol,分子数目为0.1NA,故D正确;
,Mg的化合价从0价升高到+2价,镁与浓硫酸反应为Mg+2H2SO4(浓)= MgSO4+2H2O+SO2↑,浓硫酸反应到后期形成了稀硫酸,镁与稀硫酸反应为Mg+H2SO4= MgSO4+H2↑,无论是生成氢气,还是生成二氧化硫,都是1molMg生成1mol气体,则0.1mol镁生成气体的物质的量为0.1mol,分子数目为0.1NA,故D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】NH3的催化氧化是工业制取硝酸的关键步骤之一,该反应的化学方程式为:
4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g),△H<0。
4NO(g)+6H2O(g),△H<0。
请回答下列问题:
(1)在恒温恒容下判断该反应达到平衡状态的标志是________(填字母)。
a.NH3和NO浓度相等
b.NO百分含量保持不变
c.容器中气体的压强不变
d.NH3的生成速率与NO的消耗速率相等
(2)当该反应处于平衡状态时,在体积不变的条件下,下列措施中有利于提高NH3平衡转化率的是_____________。(填字母)
a.向装置中再充入N2 b.向装置中再充入O2 c.改变反应的催化剂 d.降低温度
(3)将0.050 mol NH3 (g)和0.060 mol O2(g)放入容积为1L的密闭容器中,在一定条件下达到平衡,测得c(NO)=0.040 mol/L。计算该条件下反应的NH3的转化率和写出平衡常数K 的表达式(不必写出计算过程)。
①平衡常数的表达式K=________________;
②平衡时,NH3的转化率α(NH3 )=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下述转化关系,回答问题:

已知:①+CH3Br![]() CH3+HBr;
CH3+HBr;
②C物质苯环上一卤代物只有两种。
(1)写出B物质的名称__________;D物质的结构简式________。
(2)写出反应②的类型________;反应⑤的条件________。
(3)写出反应⑥的化学方程式:________________________________。
(4)写出D+E反应的化学方程式:_______________。
(5)反应②还有可能生成一种C16H18的有机物,其苯环上一卤代物也只有两种,写出它的结构简式:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。回答下列问题:
(1)W、X对应的两种最高价氧化物的水化物可以反应生成盐和水,该反应的离子方程式为______________________________________________________。
(2)X的硝酸盐水溶液显______性,用离子方程式解释原因______________________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为____________。
(4)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是: > > > 。(填写离子符号)_____________
(5)Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量。写出该反应的热化学方程式:___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃、101kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5kJ/mol、285.8kJ/mol、890.3kJ/mol、2800kJ/mol,则热化学方程式正确的是
A.C(s)+![]() O2(g)=CO(g) △H=-393.5kJ/mol
O2(g)=CO(g) △H=-393.5kJ/mol
B.2H2(g)+O2(g)=2H2O(g) △H=+571.6kJ/mol
C.CH4(g)+2O2(g)=2H2O(l)+CO2(g) △H=-890.3kJ/mol
D.![]() C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(g) △H=-1400kJ/mol
C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(g) △H=-1400kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是
A. 红棕色的NO2加压后颜色先变深后变浅 B. 温度过高对合成氨不利
C. 钢铁在潮湿的空气中容易生锈 D. 常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】被称之为“软电池”的纸质电池,其电池总反应为Zn+2MnO2+H2O![]() ZnO+2MnO(OH)。下列说法正确的是( )
ZnO+2MnO(OH)。下列说法正确的是( )
A.该电池的正极为锌
B.该电池反应中二氧化锰起催化剂作用
C.当65 g Zn完全溶解时,流经电极的电子为1mol
D.电池正极反应式为2MnO2+2e-+2H2O![]() 2MnO(OH)+2OH-
2MnO(OH)+2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期元素,原子序数依次增大,A、E同主族,D、F同主族,A元素的原子半径是所有原子中最小的,B元素原子的最外层电子数是内层电子数的2倍,C元素的最高价氧化物的水化物X与其氢化物反应生成一种盐Y,A、B、C、E、F五种元素都能与D元素形成原子个数比不相同的常见化合物。回答下列问题:
(1)F元素在周期表中的位置__________,在以上元素最高价氧化物的水化物中,碱性最强的化合物的电子式是:__________。
(2)D、F的气态氢化物,沸点较高的是___________(填分子式)。
(3)A单质与C单质在一定条件下可化合为Z,常温下,向pH=a的Z的水溶液中加入等体积pH=b的X的水溶液,且a+b=14,充分作用后,溶液pH______7(填“>”“<”或“=”),原因是_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从镍矿石尾矿中提取NiSO4是解决我国镍资源匮乏的一条重要途径,已知该过程如下:
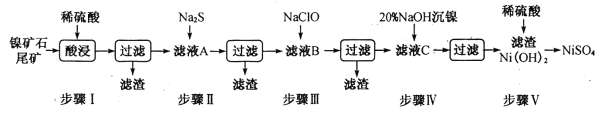
表1:各物质的Ksp数据如下表:
物质 | MnS | NiS | PbS | CuS | Ni(OH)2 |
Ksp | 2.5×10-13 | 1.1×10-21 | 8.0×10-28 | 6.3×10-36 | 2.0×10-15 |
表2:滤液A中各金属离子的含量如下表:
成分 | Ni2+ | Fe3+ | Fe2+ | Mn2+ | Cu2+ | Pb2+ | …… |
含量/g·L-1 | 3.80 | 4.80 | x | 0. 20 | 0.15 | <0.001 | …… |
根据以上信息,回答下列问题:
(1)步骤I酸浸之前需将矿石粉碎,目的是_______________。
(2)
(3)常温下进行步骤Ⅲ的目的是为了除去铁和锰元素,已知除铁元素的离子反应如下:2Fe2++ ClO - +5H2O=2Fe( OH)3↓+Cl- +4H+,此时Mn2+的氧化产物为MnO2,写出除锰元素的离子方程式_____________。
(4)所得Ni(OH)2是制造镍镉电池的重要原料,镍镉电池工作原理如下:Cd+2NiO(OH) +2H2O![]() Cd(OH)2+2Ni(OH)2,则随着放电的进行,正极区pH______(填“增大”、“减小”或“不变”);充电时阴极电极反应式为______________________。
Cd(OH)2+2Ni(OH)2,则随着放电的进行,正极区pH______(填“增大”、“减小”或“不变”);充电时阴极电极反应式为______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com