
【题目】根据下图所示实验,回答问题:

(1)实验①观察到的现象是________________________。
(2)实验②观察到的现象是________________________。

(3)实验③观察到的现象是________________________。实验④观察到的现象是________________________。
(4)由上述实验,你能得出的结论是________________________。
【答案】熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液加酚酞变红 加热前镁条表面有少量无色气泡,加热沸腾后,有较多无色气泡冒出,溶液变粉红色 有无色气泡冒出,但试管中逸出气体的速率较快 有无色气泡冒出,但试管中逸出气体的速率较慢 钠、镁、铝置换水(或酸)中的氢由易到难的顺序是Na>Mg>Al。
【解析】
金属的通性:金属活泼性在氢前面的金属均可与水或酸反应置换出氢气,根据现象可判断金属活泼性的强弱。
(1)钠的熔点低,密度比水小,与水剧烈反应生成氢气和氢氧化钠,故现象为:钠熔成小球,浮于水面,四处游动,有“嘶嘶”的响声,反应后溶液加酚酞变红;
(2)镁在常温下与水反应不是很明显,仔细观察可看到有气泡产生;加热后生成氢气和氢氧化镁;现象为:加热前镁条表面有少量无色气泡,加热沸腾后,有较多无色气泡冒出,溶液变粉红色;
(3)金属活泼性在氢前面的金属均可与酸反应置换出氢气,金属性强弱:镁>铝,实验③④中都有无色气泡冒出,但放镁条的试管中逸出气体的速率较快;故答案为:有无色气泡冒出,但试管中逸出气体的速率较快;有无色气泡冒出,但试管中逸出气体的速率较慢;
(4)根据以上几组实验可知,钠与冷水反应剧烈,镁与冷水几乎不反应,能与热水反应;镁、铝都能置换出酸中的氢,镁更容易;即钠、镁、铝置换水(或酸)中的氢由易到难的顺序是Na>Mg>Al。


科目:高中化学 来源: 题型:
【题目】随新能源汽车的发展,新能源电池技术也在不断创新,典型的锂离子电池一般以LiCoO2或LiFePO4等为正极材料,以石墨碳为负极材料,以溶有LiPF6等的有机溶液为电解质溶液。
(1)P原子的电子排布式为_________。Fe2+中未成对电子数为___________。
(2)N、O、F原子的第一电离能由小到大的顺序为_______。
(3)等电子体具有相似的化学键特征,它们的许多性质是相近的。ClO4-与PO43-互为等电子体,ClO4-的立体构型为_______,中心原子的杂化轨道类型为________。
(4)烷烃同系物中,CH4的沸点最低,原因是______________。
(5)向CuSO4溶液中加入氨水,首先形成蓝色沉淀,继续加氨水,沉淀溶解,得到深蓝色溶液,在此溶液中加入乙醇,析出深蓝色的晶体。由蓝色沉淀得到深蓝色溶液的离子方程式为_______________;深蓝色晶体中存在的化学键类型有__________ 。(填代号)
A.离子键
B.σ键
C.非极性共价键
D.配位键
E.金属键
F.氢键
(6)如图所示为Co的某种氧化物的晶胞结构图,则该氧化物的化学式为______;若该晶胞的棱长为a pm,则该晶体的密度为_____________g/cm3。(NA为阿伏加德罗常数的值)
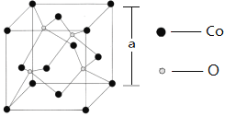
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂的某些化合物是性能优异的材料。请回答:
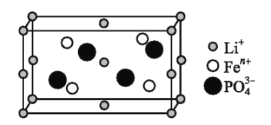
(1)如图是某电动汽车电池正极材料的晶胞结构示意图,其化学式为 ______ ,其中![]() 的基态电子排布式为 ______ ,
的基态电子排布式为 ______ ,![]() 的空间构型为 ______ 。
的空间构型为 ______ 。
(2)![]() 与Na中第一电离能较小的元素是 ______ ;LiF与NaCl晶体中熔点较高的是 ______ 。
与Na中第一电离能较小的元素是 ______ ;LiF与NaCl晶体中熔点较高的是 ______ 。
(3)氮化锂是一种良好的储氢材料,其在氢气中加热时可吸收氢气得到氨基锂![]() 和氢化锂,氢化锂的电子式为 ______ ,上述反应的化学方程式为 ______。
和氢化锂,氢化锂的电子式为 ______ ,上述反应的化学方程式为 ______。
(4)金属锂为体心立方晶胞,其配位数为 ______ ;若其晶胞边长为apm,则锂晶体中原子的空间占有率是 ______ 。
(5)有机锂试剂在有机合成中有重要应用,但极易与![]() 、
、![]() 等反应.下列说法不正确的是 ______
等反应.下列说法不正确的是 ______ ![]() 填字母序号
填字母序号![]() 。
。
A.CO2中σ键与π键的数目比为1:1
B.游离态和化合态锂元素均可由特征发射光谱检出
C.叔丁基锂(C4H9Li)中碳原子的杂化轨道类型为sp3和sp2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生欲探究FeSO4溶液与浓HNO3的反应。
该同学向盛有FeSO4溶液的试管中滴入数滴浓硝酸,并振荡试管,预期现象为试管中会立即产生红棕色气体,溶液焰色逐渐变黄。但实际操作时观察到液面上方气体变化红棕色,且试管中溶液颜色变为深棕色。
为了进一步探究溶液变为深棕色的原因,该同学进行如下实验。
回答下列问题
(1)向FeSO4溶液和反应后溶液中加入KSCN溶液,前者不变红色,后者变红,该现象的结论是________。
(2)该同学通过查阅资料,认为溶液的深棕色可能是NO2或NO与溶液中Fe2+或Fe3+发生反应而得到的。为此他利用如图装置(气密性已检验,尾气处理装备略)进行探究。
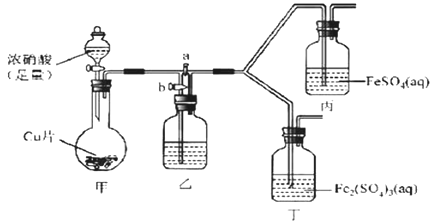
Ⅰ.打开活塞a、关闭b,并使甲装置中反应开始后,观察到丙中溶液逐渐变为深棕色,而丁中溶液无明显变化。
Ⅱ.打开活塞b、关闭a,一段时间后再停止甲中反应。
Ⅲ.为与Ⅰ中实验进行对照重新更换丙、丁后,使甲中反应重复进行步骤Ⅰ实验,观察到的现象与步骤Ⅰ中相同。
①铜与足量浓硝酸反应的离子方程式是_______________。
②装置乙的试剂为____________________。
③步骤Ⅱ的目的是_______________________。
④该实验可得出的结论是______________________。
(3)该同学重新进行FeSO4溶液与浓HNO3的反应的实验,观察到了预期现象,其实验操作是_________,反应的离子方程式为___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某学生为探究AgCl沉淀转化为![]() 沉淀的反应所做实验的记录.
沉淀的反应所做实验的记录.
步骤 | 现象 |
Ⅰ | 立即产生白色沉淀 |
Ⅱ | 沉淀迅速变为黑色 |
Ⅲ | 较长时间后,沉淀变为乳白色 |
Ⅳ | 产生红棕色气体,沉淀部分溶解 |
Ⅴ | 产生白色沉淀 |
![]() 为了证明沉淀变黑是AgCl转化为
为了证明沉淀变黑是AgCl转化为![]() 的缘故,步骤I中NaCl溶液的体积范围为 ______ 。
的缘故,步骤I中NaCl溶液的体积范围为 ______ 。
![]() 已知:
已知:![]() 时
时![]() ,
,![]() ,此沉淀转化反应的平衡常数
,此沉淀转化反应的平衡常数![]() ______。
______。
![]() 步骤V中产生的白色沉淀的化学式为 ______ ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 ______。
步骤V中产生的白色沉淀的化学式为 ______ ,步骤Ⅲ中乳白色沉淀除含有AgCl外,还含有 ______。
![]() 为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
为了进一步确认步骤Ⅲ中乳白色沉淀产生的原因,设计了如下图所示的对比实验装置。
![]() 装置A中玻璃仪器有圆底烧瓶、导管和 ______ ,试剂W为 ______ 。
装置A中玻璃仪器有圆底烧瓶、导管和 ______ ,试剂W为 ______ 。
![]() 装置C中的试剂为NaCl溶液和
装置C中的试剂为NaCl溶液和![]() 悬浊液的混合物,B中试剂为 ______ 。
悬浊液的混合物,B中试剂为 ______ 。
![]() 实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
实验表明:C中沉淀逐渐变为乳白色,B中没有明显变化。
完成C中反应的化学方程式:______Ag2S+_____NaCl+______ + ______ AgCl+S+ ______
______
C中NaCl的作用是: ______ 。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:X2(g) + 3Y2(g) ![]() 2XY3(g) △H=-92.6kJ/mol
2XY3(g) △H=-92.6kJ/mol
实验测得反应在起始、达到平衡时的有关数据如下表所示:
容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
X2 | Y2 | XY3 | ||
① | 1 | 3 | 0 | 23.15 kJ |
② | 0.6 | 1.8 | 0.8 | Q kJ |
下列叙述正确的是
A. 容器①、②中反应的平衡常数不相等
B. 达平衡时,两个容器中XY3的物质的量浓度均为2 mol/L
C. 容器②中反应达到平衡时放出的热量为23.15kJ
D. 若容器①体积为0.20 L,则达平衡时放出的热量小于23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼及其化合物在新材料、工农业生产等方面用途很广。请回答下列问题:
![]() 元素的基态原子的价电子排布图为______,B、N、O元素的第一电离能由大到小的顺序为______。
元素的基态原子的价电子排布图为______,B、N、O元素的第一电离能由大到小的顺序为______。
![]() 三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性气味的无色有毒腐蚀性气体,其分子的立体构型为______,B原子的杂化类型为______。
三氟化硼在常温常压下为具有刺鼻恶臭和强刺激性气味的无色有毒腐蚀性气体,其分子的立体构型为______,B原子的杂化类型为______。
![]() 自然界中,含B的钠盐是一种天然矿藏,其化学式写作
自然界中,含B的钠盐是一种天然矿藏,其化学式写作![]() ,实际上它的阴离子结构单元是由两个
,实际上它的阴离子结构单元是由两个![]() 和两个
和两个![]() 缩合而成的双六元环,应该写成
缩合而成的双六元环,应该写成![]() ,其结构式如图1,它的阴离子可形成链状结构。该阴离子由极性键和配位键构成,请在答题卷中抄上图1结构式后用“
,其结构式如图1,它的阴离子可形成链状结构。该阴离子由极性键和配位键构成,请在答题卷中抄上图1结构式后用“![]() ”标出其中的配位键,该阴离子通过______相互结合形成链状结构。
”标出其中的配位键,该阴离子通过______相互结合形成链状结构。

![]() 科学家发现硼化镁在39K时有超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图2是该晶体微观结构中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影。则硼化镁的化学式为______。
科学家发现硼化镁在39K时有超导性,在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,一层镁一层硼相间排列。图2是该晶体微观结构中取出的部分原子沿z轴方向的投影,白球是镁原子投影,黑球是硼原子投影。则硼化镁的化学式为______。
![]() 磷化硼
磷化硼![]() 是一种有价值的超硬耐磨涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。磷化硼晶胞如图3所示,在BP晶胞中B的堆积方式为______,当晶胞晶格参数为478pm时,磷化硼中硼原子和磷原子之间的最近距离为______cm。
是一种有价值的超硬耐磨涂层材料,这种陶瓷材料可作为金属表面的保护薄膜。磷化硼晶胞如图3所示,在BP晶胞中B的堆积方式为______,当晶胞晶格参数为478pm时,磷化硼中硼原子和磷原子之间的最近距离为______cm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在等温等容条件下,有下列气体反应:2A(g)+2B(g)![]() C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ:A、B的起始浓度均为2mol/L。Ⅱ:C、D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是( )
C(g)+3D(g)。现分别从两条途径建立平衡:Ⅰ:A、B的起始浓度均为2mol/L。Ⅱ:C、D的起始浓度分别为2mol/L和6mol/L。下列叙述正确的是( )
A.Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的平均相对分子质量不同
B.Ⅰ和Ⅱ两途径最终达到平衡时,系统内混合气体的百分组成不同
C.达到平衡时Ⅰ途径的VA等于Ⅱ途径的VA
D.达到平衡后,第Ⅰ途径混合气密度为第Ⅱ途径混合气密度的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究实验室制乙烯及乙烯和溴水的加成反应。甲同学设计了如图所示的实验装置,并进行了实验。当温度升至170℃左右时,有大量气体产生,产生的气体通入溴水中,溴水的颜色迅速褪去。甲同学认为达到了实验目的。
乙同学仔细考察了甲同学的整个实验过程,发现当温度升到100℃左 右时,无色液体开始变色,到160℃左右时,混合液全呈黑色,在170℃超过后生成气体速度明显加快,生成的气体有刺激性气味。由此他推出,产生的气体中应有杂质,可能影响乙烯的检出,必须除去。据此回答下列问题:

(1)写出甲同学实验中两个反应的化学方程式:_____________、___________________________。
(2)乙同学观察到的黑色物质是_____________,刺激性气体是_____________。乙同学认为刺激性气体的存在就不能认为溴水褪色是乙烯的加成反应造成的。原因是(用化学方程表示):________。
(3)丙同学根据甲乙同学的分析,认为还可能有CO、CO2两种气体产生。为证明CO存在,他设计了如下过程(该过程可把实验中产生的有机产物除净):发现最后气体经点燃是蓝色火焰,确认有一氧化碳。

①设计装置a的作用是____________________
②浓溴水的作用是_______________________,稀溴水的作用是____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com