
【题目】(1)有机物A中只含C、H、O三种元素,A的蒸气密度是相同状况下氢气密度的83倍,分子中碳原子总数是氧原子总数的3倍,则A的分子式为________。
(2)芳香烃B的相对分子质量在100~110之间,1 mol B充分燃烧可生成72 g水,则B的分子式是________。
(3)某含C、H、O三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是________,通过质谱仪测定其相对分子质量为74,则其分子式为________。
【答案】C9H10O3 C8H8 C4H10O C4H10O
【解析】
(1) A的蒸气密度是相同状况下氢气密度的83倍,则A的相对分子质量=2×83=166。碳原子总数是氧原子总数的3倍,设有机物的分子式为:C3xHyOx,那么有:36x+y+16x=166,因为x、y均为正整数,所以解得x1=1和y1=114(舍去)、x2=2和y2=62(舍去)、x3=3和y3=10,所以该有机物的分子式为:C9H10O3,故答案为:C9H10O3;
(3)设B的分子式为CxHy,1 mol B充分燃烧可生成72g水的物质的量=![]() =4mol,根据H原子守恒可知:y=8,分子式为:CxH8,又因为B的相对分子质量在100~110之间,x为正整数,所以,x=8,故A的分子式为:C8H8,故答案为:C8H8;
=4mol,根据H原子守恒可知:y=8,分子式为:CxH8,又因为B的相对分子质量在100~110之间,x为正整数,所以,x=8,故A的分子式为:C8H8,故答案为:C8H8;
(3)碳的质量分数是64.86%,氢的质量分数是13.51%,那么,氧的质量分数=1-64.86%-13.51%=21.63%, C、H、O的个数比=![]() :
:![]() :
:![]() ≈4:10:1,所以,该有机物的实验式为:C4H10O。相对分子质量为74,则该有机物分子式为:C4H10O,故答案为:C4H10O;C4H10O。
≈4:10:1,所以,该有机物的实验式为:C4H10O。相对分子质量为74,则该有机物分子式为:C4H10O,故答案为:C4H10O;C4H10O。


科目:高中化学 来源: 题型:
【题目】
化合物M是合成香精的重要原料。实验室由A和芳香烃E制备M的一种合成路线如下:
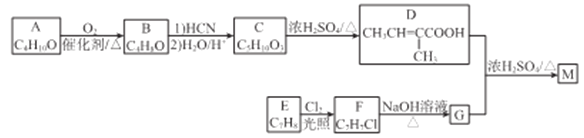
已知: (R1、R2表示烃基或H原子)
(R1、R2表示烃基或H原子)
请回答下列题:
(1)A的化学名称为_________,B的结构简式为________。
(2)C中官能团的名称为________。
(3)D分子中最多有___个原子共平面。
(4)E→F的反应类型为________。
(5)D+G→M的化学方程式为________。
(6)同时满足下列条件的D的同分异构体有___种(不考虑立体异构),其中核磁共振氢谱有3组峰的结构简式为________。
①能发生水解反应和银镜反应; ②不含环状结构
(7)参照上述合成路线和信息。以![]() 为原料(其他无机试剂任选),设计制备
为原料(其他无机试剂任选),设计制备 的合成路线_______________________。
的合成路线_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应过程中不存在电子转移的是( )
A.Zn+2HCl=ZnCl2+H2↑
B.Ca(ClO)2+2HCl=CaCl2+2HClO
C.Pb3O4+8HCl(浓)=3PbCl2+Cl2↑+4H2O
D.3Cl2+6KOH(浓)![]() 5KCl+KClO3+3H2O
5KCl+KClO3+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和水都是常用的试剂。请回答下列问题:
(1)氮元素基态原子的核外电子中,未成对电子数成对电子数之比为_____。
(2)NH3分子可结合一个H+形成铵根离子(NH4+)。
①NH3分子中N原子的杂化类型是_____。
②NH3分子中与H+结合的过程中未发生改变的是_____(填序号)。
a 微粒的空间构型 b N原子的杂化类型 c H—N—H的键角
(3)将氨气通入CuSO4溶液中,产生蓝色沉淀,继续通过量氨气,沉淀溶解,得到蓝色透明溶液。该过程中微粒的变化是[Cu(H2O)6]2+→Cu(OH)2→[Cu(NH3)4]2+。 [Cu(H2O)6]2+和[Cu(NH3)4]2+中共同含有的化学键类型是_______。
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,则冰晶体中氢键的“键能”是_____ kJ·mol(已知冰的升华热是51 kJ·mol-1),水分子间范德华力的能量为11 kJ·mol-1);水变成冰晶体时,密度减小的主要原因是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下可逆反应:A(s)+2B(g)![]() C(g)+D(g);△H<0。现将1mol A和2mol B加入甲容器中,将2mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是
C(g)+D(g);△H<0。现将1mol A和2mol B加入甲容器中,将2mol C和2mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍(如图所示,隔板K不能移动),t1时两容器内均达到平衡状态。下列说法正确的是
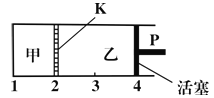
A.升高温度,达到新平衡后,甲中B的体积分数增大,乙中B的体积分数减小
B.将活塞由“4”推进到“3”,达到新平衡后,甲、乙两容器中C的百分含量相同
C.保持温度不变,向甲中再加入1mol A和2mol B,达到新平衡后,c(B)甲>2c(B)乙
D.保持温度和乙中压强不变,向乙中再加入2mol D,达到新平衡后,c(B)乙≤2c(B)甲
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子检验的方法正确的是( )
A.某溶液中加硝酸银溶液生成白色沉淀,说明原溶液中有![]()
B.某溶液中加![]() 溶液生成白色沉淀,说明原溶液中有
溶液生成白色沉淀,说明原溶液中有![]()
C.某溶液中加NaOH溶液生成蓝色沉淀,说明原溶液中有![]()
D.某溶液中加稀硫酸溶液生成无色无味气体,说明原溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒压、NO和O2的起始浓度一定的条件下,催化反应相同时间,测得不同温度下NO转化为NO2的转化率如图中实线所示(图中虚线表示相同条件下NO的平衡转化率随温度的变化)。下列说法正确的是( )
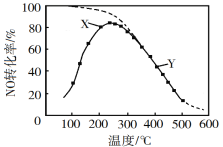
A.反应2NO(g)+O2(g)![]() 2NO2(g)的ΔH>0
2NO2(g)的ΔH>0
B.图中X点所示条件下,延长反应时间不能提高NO转化率
C.图中Y点所示条件下,增加O2的浓度不能提高NO转化率
D.380℃下,c起始(O2)=5.0×104 mol·L1,NO平衡转化率为50%,则平衡常数K>2000
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚碳酸酯( )的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X(
)的透光率良好。它可制作车、船、飞机的挡风玻璃,以及眼镜片、光盘、唱片等。它可用绿色化学原料X(![]() )与另一原料Y反应制得,同时生成甲醇。下列说法不正确的是
)与另一原料Y反应制得,同时生成甲醇。下列说法不正确的是
A. Y的分子结构中有2个酚羟基 B. Y的分子式为C15H18O2
C. X的核磁共振氢谱有1个吸收峰 D. X、Y生成聚碳酸酯发生的是缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某同学探究Na2SO3溶液和铬(VI)盐溶液反应规律的实验记录,已知:Cr2O72-(橙色)+ H2O![]() 2CrO42-(黄色)+ 2H+
2CrO42-(黄色)+ 2H+
序号 | a | b | 现象 | |
| 1 | 2 mL 0.05 mol·L1 K2Cr2O7溶液(pH = 2) | 3滴饱和Na2SO3溶液(pH = 9) | 溶液变绿色(含Cr3+) |
2 | 2 mL 0.1 mol·L1 K2CrO4溶液(pH = 8) | 3滴饱和Na2SO3溶液 | 溶液没有明显变化 | |
3 | 2 mL饱和Na2SO3溶液 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变黄色 | |
4 | 2 mL蒸馏水 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变成浅橙色 |
下列说法不正确的是
A. 实验1中的绿色溶液中含有SO42-
B. 实验1、2的a溶液中所含的离子种类相同
C. 向实验3溶液中继续滴加过量硫酸可使溶液变为浅橙色
D. 实验4的目的是排除稀释对溶液颜色变化造成的影响
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com