
【题目】氨和水都是常用的试剂。请回答下列问题:
(1)氮元素基态原子的核外电子中,未成对电子数成对电子数之比为_____。
(2)NH3分子可结合一个H+形成铵根离子(NH4+)。
①NH3分子中N原子的杂化类型是_____。
②NH3分子中与H+结合的过程中未发生改变的是_____(填序号)。
a 微粒的空间构型 b N原子的杂化类型 c H—N—H的键角
(3)将氨气通入CuSO4溶液中,产生蓝色沉淀,继续通过量氨气,沉淀溶解,得到蓝色透明溶液。该过程中微粒的变化是[Cu(H2O)6]2+→Cu(OH)2→[Cu(NH3)4]2+。 [Cu(H2O)6]2+和[Cu(NH3)4]2+中共同含有的化学键类型是_______。
(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键,则冰晶体中氢键的“键能”是_____ kJ·mol(已知冰的升华热是51 kJ·mol-1),水分子间范德华力的能量为11 kJ·mol-1);水变成冰晶体时,密度减小的主要原因是________________________________。
【答案】3∶4 sp3 b 极性键、配位键 20 氢键具有方向性,水结冰时分子间距离增大,密度减小
【解析】
(1)书写N原子的核外电子排布式,根据各能级含有的电子数目及轨道数目判断,每个轨道最多容纳2个自旋方向相反的电子,且电子优先占据1个轨道;
(2)①NH3分子中N原子呈3个N-H,含有1对孤对电子,杂化轨道数目为4,据此判断;
②NH3分子是三角锥型,NH4+是正四面体型,键角不同,二者N原子杂化轨道数目相同,都采取sp3杂化;
(3)铜离子与水分子、氨气分子之间形成配位键,水分子、氨分子中都存在共价键;
(4)每个氢键为1个水分子提供,故1mol冰中含有2mol氢键,升华热=氢键能量+水分子间范德华力能量;
氢键具有方向性,水结冰时分子间距增大,晶体内部有很大的间隙.
(1)N原子的核外电子排布式为1s22s22p3,s能级有1个轨道,1s、2s电子为成对电子,2p能级有3个轨道,3个电子各占据1个轨道,是未成对电子,故未成对电子数与成对电子数之比为3:4,故答案为:3:4;
(2)①NH3分子中N原子呈3个N-H,含有1对孤对电子,杂化轨道数目为4,采取sp3杂化,故答案为:sp3;
②NH3分子是三角锥型,NH4+是正四面体型,H—N—H的键角不同,NH4+中N原子呈4个N-H,杂化轨道数目为4,采取sp3杂化,都采取sp3杂化,故答案为:b;
(3) [Cu(H2O)6]2+和[Cu(NH3)4]2+中铜离子与水分子、氨气分子之间形成配位键,水分子中O-H键、氨分子中N-H键都是共价键,故答案为:共价键、配位键;
(4)每个氢键为1个水分子提供![]() ,故1mol冰中含有2mol氢键,令氢键的具有的能量为E kJ·mol-1,则:2E kJ·mol-1+11kJ·mol-1=51kJ·mol-1,解得E=20;由于氢键具有方向性,水结冰时分子间距增大,晶体内部有很大的间隙,故冰的密度小于水,故答案为:20;氢键具有方向性,水结冰时分子间距增大,晶体内部有很大的间隙。
,故1mol冰中含有2mol氢键,令氢键的具有的能量为E kJ·mol-1,则:2E kJ·mol-1+11kJ·mol-1=51kJ·mol-1,解得E=20;由于氢键具有方向性,水结冰时分子间距增大,晶体内部有很大的间隙,故冰的密度小于水,故答案为:20;氢键具有方向性,水结冰时分子间距增大,晶体内部有很大的间隙。


科目:高中化学 来源: 题型:
【题目】A是化学实验室中最常见的有机物,它易溶于水并有特殊香味,能进行如图所示的多种反应。
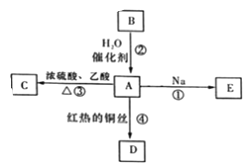
(1)A的官能团名称是____________,B的结构简式____________。
(2)反应②的反应类型为________________________________。
(3)发生反应①时钠在__________________________(填“液面上方”或“液体底部”)。
(4)写出反应③的化学方程式_______________________。
(5)写出反应④的化学方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.按系统命名法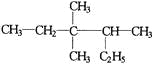 的名称为3,3—二甲基—2—乙基戊烷
的名称为3,3—二甲基—2—乙基戊烷
B.乙烯、乙炔是较活泼的有机物,能发生氧化反应,甲烷和苯性质较稳定,不能发生氧化反应
C.分子式为C5H12O的醇共有8种,其中能催化氧化成醛的同分异构体有4种
D.A、B两种有机化合物,无论以何种比例混合,只要混合物的总质量不变,完全燃烧后,产生水的质量也不变,则A、B满足的条件必须是最简式相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PTT是一种高分子材料,能作为纺织纤维和地毯等材料而得到广泛应用。其合成路线可设计为:
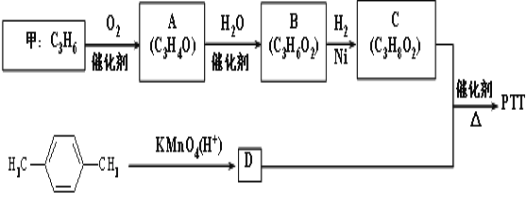
其中A、B、C均为链状化合物,A能发生银镜反应,C不含甲基,1molC可与足量钠反应生成22.4LH2(标准状况)。请回答下列问题:
(1)A的结构简式为___,C的名称___(系统命名)。
(2)1molD与足量的烧碱溶液反应最多消耗NaOH___mol。
(3)指出反应类型A→B___;C和D生成PTT___。
(4)由物质B生成C的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氧化铁样品中含有少量的硫酸亚铁。某同学要测定其中铁元素的质量分数,设计了如下实验方案。

(1)操作Ⅰ中配制溶液时,所用到的玻璃仪器除烧杯、量筒、玻璃棒、胶头滴管以外,还必须有__________(填仪器名称)。
(2)反应①中加入足量H2O2溶液,反应的离子方程式:_______________________________。
(3)检验沉淀中![]() 是否洗涤干净的操作是_______________________________________。
是否洗涤干净的操作是_______________________________________。
(4)将沉淀加热,冷却至室温,用天平称量坩埚与加热后固体的总质量为b1g,再次加热并冷却至室温称其质量为b2g,若b1-b2=0.3,还应进行的操作是_____________________。
(5)坩埚的质量为42.6 g,最终坩埚与加热后的固体的总质量为45.8 g,则样品中铁元素的质量分数为________________。
(6)有同学认为上述方案的实验步骤太繁琐,他认为,只要将样品溶于水充分搅拌,加热、蒸干、灼烧称量即可测得样品中铁元素的质量分数,你认为他的这个方案是否可行?__________(填“可行”或“不可行”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。反应:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是 ( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是 ( )
A.提高尾气净化速率的常用方法是降低温度
B.提高尾气净化速率的最佳途径是研制高效催化剂
C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)有机物A中只含C、H、O三种元素,A的蒸气密度是相同状况下氢气密度的83倍,分子中碳原子总数是氧原子总数的3倍,则A的分子式为________。
(2)芳香烃B的相对分子质量在100~110之间,1 mol B充分燃烧可生成72 g水,则B的分子式是________。
(3)某含C、H、O三种元素的有机物,经燃烧分析实验测定其碳的质量分数是64.86%,氢的质量分数是13.51%,则其实验式是________,通过质谱仪测定其相对分子质量为74,则其分子式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,容器甲内充入0.1 mol NO气体。干燥管内装有一定量Na2O2,从A处缓慢通入CO2气体。恒温下,容器甲中活塞缓慢由D处向左移动,当移至C处时容器体积缩至最小,为原体积9/10,干燥管中物质的质量增加了2.24 g。随着CO2的继续通入,活塞又逐渐向右移动。下列说法中正确的是

A. 活塞从D处移动到C处的过程中,通入的CO2气体为2.24 L(标准状况)
B. NO2转化为N2O4的转化率为20%
C. 容器甲中NO已反应完
D. 活塞移至C处后,继续通入a mol CO2,此时活塞恰好回至D处,则a小于0.01
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Zn原子的核外电子排布式________。
(2)根据等电子原理,写出CO分子的结构式______。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是______________;甲醛分子中碳原子轨道的杂化类型为________。
②甲醛分子的空间构型是________;1 mol甲醛分子中σ键的数目为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com