
【题目】现有浓度均为0.01mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸氢铵、⑦氨水。请回答下列问题:
(1)①、②、③、④四种溶液中,水电离出的c(H+)由大到小的顺序是_________(填序号)。
(2)④、⑤、⑥、⑦四种溶液中,c(NH4+)由大到小的顺序是_______(填序号)。
(3)将③和④按体积比1:2混合后,混合液中各离子浓度由大到小的顺序是_______。
(4)已知T℃时,③溶液的pH=11,该温度下,水的离子积Kw=______________;该温度下,将pH之和为13的NaOH溶液和醋酸溶液等体积混合后,所得溶液呈____(填“酸”“碱”或“中”)性。T℃时,将aL pH=11的NaOH溶液与bL pH=1的H2SO4溶液混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则a:b=________。
【答案】④>②>③>① ⑥>④>⑤>⑦ c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) 10-13 酸 9:2
【解析】
(1)酸或碱抑制水电离,含有弱根离子的盐促进水电离;
(2)从盐类的水解和弱电解质的电离程度角度分析;
(3)③和④等体积混合后,溶液溶质为NaCl和NH4Cl、NH3·H2O,从盐类的水解和弱电解质的电离程度角度分析;
(4)0.01mol·L-1NaOH溶液中c(OH-)=10-2mol·L-1,已知pH=11,根据Kw的公式计算;
pH之和为13的NaOH溶液和醋酸溶液,c(OH-)=c(H+),由于醋酸是弱酸,酸的浓度大于氢离子浓度;
根据c(H+)=n/V计算酸碱混合反应.
(1)④氯化铵为强酸弱碱盐,水解促进水的电离,②醋酸为弱酸,溶液中c(H+)较小,①硫酸和③氢氧化钠都为强电解质,浓度相同时,硫酸对水的电离抑制程度较大,所以四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①;
(2)④氯化铵、⑤醋酸铵、⑥硫酸氢铵等溶液中存在:NH4++H2O![]() NH3·H2O+H+,硫酸氢铵存在大量的H+,抑制NH4+的水解,醋酸铵为弱酸弱碱盐,发生相互促进的水解,三种物质中NH4+浓度最小,⑦氨水为弱电解质,难以电离,在这四种溶液中NH4+浓度最小,所以NH4+浓度由大到小的顺序是⑥④⑤⑦;
NH3·H2O+H+,硫酸氢铵存在大量的H+,抑制NH4+的水解,醋酸铵为弱酸弱碱盐,发生相互促进的水解,三种物质中NH4+浓度最小,⑦氨水为弱电解质,难以电离,在这四种溶液中NH4+浓度最小,所以NH4+浓度由大到小的顺序是⑥④⑤⑦;
(3)③和④按体积比1:2混合后,溶液溶质为NaCl和NH4Cl、氨水,根据物料守恒知,c(Cl-)>c(NH4+),由于溶液中存在:NH3·H2O![]() NH4++OH-,一水合氨的电离程度大于氢根离子水解程度,则c(NH4+)>c(Na+),溶液呈碱性得c(OH-)>c(H+),故有:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) ;
NH4++OH-,一水合氨的电离程度大于氢根离子水解程度,则c(NH4+)>c(Na+),溶液呈碱性得c(OH-)>c(H+),故有:c(Cl-)>c(NH4+)>c(Na+)>c(OH-)>c(H+) ;
(4)已知T℃时,0.01mol/L的氢氧化钠溶液的pH=11,该温度下,水的离子积Kw=0.01×10-11=1×10-13;
pH之和为13的NaOH溶液和醋酸溶液,氢氧化钠溶液中c(OH-)等于醋酸溶液中c(H+),由于醋酸是弱酸,酸的浓度大于氢离子浓度,所以混合后酸有剩余,则溶液显酸性;
在t℃时将pH=11的NaOH溶液aL与pH=1的H2SO4的溶液bL混合(忽略混合后溶液体积的变化),若所得混合溶液的pH=2,则有:[0.1mol·L-1×bL-0.01mol·L-1×aL]/(a+b)L
=0.01mol·L-1,则a:b=9:2。


科目:高中化学 来源: 题型:
【题目】化学反应原理知识在指导工业生产和环保等方面具有重要作用,请回答下列问题:
(1)已知热化学方程式:
①2C(s)+H2(g) = C2H2(g) △H1
②C(s)+O2(g) = CO2(g) △H2
③H2(g) +![]() O2(g) = H2O(l) △H3
O2(g) = H2O(l) △H3
则表示C2H2燃烧热的热化学方程式为____________________________。
(2)利用测压法在刚性反应器中加入2molSO2、1molO2,研究T℃时,反应2SO2 (g) +O2(g) ![]() 2 SO3(g) △H<0,体系的总压强p随时间t的变化如下表所示:
2 SO3(g) △H<0,体系的总压强p随时间t的变化如下表所示:
反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 40 |
压强/kPa | 20.0 | 19.5 | 18.3 | 16.0 | 16.0 | 16.0 | 22.0 |
①平衡时,SO2的转化率α= _________ %;
②T℃时,反应2SO2 (g) +O2(g) ![]() 2 SO3(g)的平衡常数Kp= ________kPa-1[气体分压(p分)=气体总压(p总)×体积分数,Kp为以分压表示的平衡常数,计算结果保留1位小数]。
2 SO3(g)的平衡常数Kp= ________kPa-1[气体分压(p分)=气体总压(p总)×体积分数,Kp为以分压表示的平衡常数,计算结果保留1位小数]。
③下图分别代表焓变(△H)、混合气体平均相对分子(![]() )、SO2 质量分数[ψ(SO2)]和混合气体压强(p)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是______________。
)、SO2 质量分数[ψ(SO2)]和混合气体压强(p)与反应时间(t)的关系,下图正确且能表明该反应达到平衡状态的是______________。
A 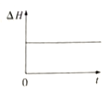 B
B 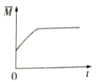 C
C  D
D 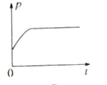
④40min时,改变的条件可能是_______________________________(写2点)。
(3)某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结构如图所示。
模拟尾气 | 气体(10 mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量/mol | 0.025 | 0.5 | 9.475 | n |
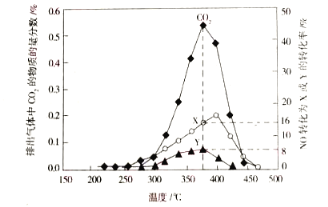
①二氧化碳的电子式为__________________。
②375℃时,测得排出的气体中含0.45molO2和0.0525molCO2,则Y的化学名称为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D四种强电解质,它们在水中电离产生下列离子(每种物质只含一种阴离子且互不重复)。
阳离子 | Na+、Ba2+、NH4+ |
阴离子 | CH3COO-、OH-、Cl-、SO42- |
已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无现象。
(1)A是__________,B是__________(填化学式) 。
(2)用离子方程式表示A溶液pH大于7的原因:
(3)写出C和D反应的离子方程式 。
(4)25 ℃时,0.1 mol·L-1 B溶液的pH=a,则B溶液中c(H+)-c(NH3·H2O)=_____________(用含有a的关系式表示)。
(5)将等体积、等物质的量浓度的B溶液和C溶液混合,反应后溶液中各种离子浓度由大到小的顺序是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯离子插层镁铝水滑石![]() 是一种新型离子交换材料,其在高温下完全分解为
是一种新型离子交换材料,其在高温下完全分解为![]() 、
、![]() 、
、![]() 和水蒸气,现用如图装置进行实验确定其化学式(固定装置略去)。
和水蒸气,现用如图装置进行实验确定其化学式(固定装置略去)。

(1)![]() 热分解的化学方程式为______________________。
热分解的化学方程式为______________________。
(2)若只通过测定装置C、D的增重来确定![]() ,则装置的连接顺序为_____________按气流方向,用接口字母表示),其中C的作用是________________。
,则装置的连接顺序为_____________按气流方向,用接口字母表示),其中C的作用是________________。
(3)加热前先通过![]() 排尽装置中的空气,称取C、D的初始质量后,再持续通入
排尽装置中的空气,称取C、D的初始质量后,再持续通入![]() 的作用是将分解产生的气体全部带入装置C、D中完全吸收、_____________等。
的作用是将分解产生的气体全部带入装置C、D中完全吸收、_____________等。
(4)完全分解后测得C增重3.65g 、D增重9.90g ,则![]() =_____________,若取消冷却玻管B后进行试验,测定
=_____________,若取消冷却玻管B后进行试验,测定![]() 值将______________(填“偏高”或“偏低”)。
值将______________(填“偏高”或“偏低”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1molL-1的HCl溶液滴定10.00mL 0.1mol/LROH,其滴定曲线如图所示.AG=![]() ,下列分析不正确的是
,下列分析不正确的是

A. ROH为弱碱 B. A点溶液c(Cl)=c(R+)
C. 若b=10时,AG<0 D. 若b=15,溶液中存在c(Cl-)+c(OH-)=c(R+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g)![]() 2Z(g) 一定达到化学平衡状态的是
2Z(g) 一定达到化学平衡状态的是
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成2n mol Z,同时消耗2n mol Y
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA代表阿伏加德罗常数的值,则关于热化学方程式C2H2(g)+![]() O2(g) →2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
O2(g) →2CO2(g)+H2O(l) ΔH=-1300 kJ·mol-1的说法中,正确的是( )
A.当10NA个电子转移时,该反应吸收1300 kJ的能量
B.当1NA个水分子生成且为液体时,吸收1300 kJ的能量
C.当2NA个碳氧共用电子对生成时,放出1300 kJ的能量
D.当8NA个碳氧共用电子对生成时,放出1300 kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列示意图中,白球代表氢原子,黑球代表氦原子,方框代表容器,容器中间有一个可以上下滑动的隔板(其质量忽略不计)。其中能表示等质量的氢气与氦气的是( )
A.  B.
B.  C.
C.  D.
D. 
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室模拟工业制备硫氰化钾(KSCN)。实验装置如图:

已知:①CS2不溶于水,比水重;NH3不溶于CS2;②三颈烧瓶内盛放有CS2、水和催化剂。
实验步骤如下:
(1)制备NH4SCN溶液:CS2+3NH3![]() NH4SCN+ NH4HS(该反应比较缓慢)
NH4SCN+ NH4HS(该反应比较缓慢)
①实验前,经检验装置的气密性良好。三颈烧瓶的下层CS2液体必须浸没导气管口,目的是_____。
②实验开始时打开K1,加热装置A、D,使A中产生的气体缓缓通入D中,至CS2消失。
则:装置A中反应的化学方程式是_____;装置C的作用是______。
(2)制备KSCN溶液:熄灭A处的酒精灯,关闭K1,移开水浴,将装置D继续加热至105℃,当NH4HS完全分解后(NH4HS= H2S↑ + 3NH3↑),打开K2,再缓缓滴加入适量的KOH溶液,发生反应:NH4SCN + KOH= KSCN + NH3↑ +H2O。
小组讨论后认为:实验中滴加入相同浓度的K2CO3溶液比KOH溶液更好,理由是_____。
(3)制备硫氰化钾晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,冷却结晶______,干燥,得到硫氰化钾晶体。
(4)测定晶体中KSCN的含量:称取10.0g样品配成1000mL溶液量取20.00mL于锥形瓶中,加入适量稀硝酸,再加入几滴Fe(NO3)3溶液做指示剂,用0.1000mol/LAgNO3标准溶液滴定,达到滴定终点时消耗AgNO3标准溶液20.00mL。
①滴定时发生的反应:SCN- + Ag+= AgSCN↓(白色)。则判断达到终点时的方法是____。
②晶体中KSCN的质量分数为____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com