
【题目】某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为 45.3g 的该结晶水合物,分别制成溶液向其中一份逐滴加入 NaOH 溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出, 该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到 2.24L 该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入 Ba(OH)2 溶液,开始现象类似,但最终仍有白色沉淀; 过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体 46.6g。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是_____和_____,阴离子是_____;
(2)试通过计算确定该结晶水合物的化学式。写出计算过程:_____假设过程中向该溶液中加入的 Ba(OH)2 溶液的物质的量浓度为 2.0molL1 。
(3)加入_____mLBa(OH)2 溶液时,所得沉淀的总物质的量最大。
(4)请在如图中画出生成沉淀的物质的量与加入 Ba(OH)2 溶液体积的关系示意图_____。

【答案】NH4+ Al3+ SO42- NH4Al(SO4)212H2O[或(NH4)2SO4Al2(SO4)324H2O] 100 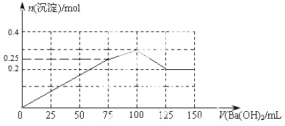
【解析】
(1)一份加入NaOH溶液,一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,该气体是氨气,明一定含有铵根离子;向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多,最后白色沉淀逐渐减少并最终消失,证明一定含有铝离子,一份加入足量Ba(OH)2溶液,生成白色沉淀,过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6g,说明含有硫酸根离子;故答案为:NH4+;Al3+;SO42-;
(2)由题中信息可知45.3g的该结晶水合物中:n(SO42-)=![]() ,n(NH4+)=
,n(NH4+)=![]() ,根据离子化合物中阴、阳离子电荷平衡的原理:n(NH4+)+3n(Al3+)=2n(SO42-)可得:n(A13+)=
,根据离子化合物中阴、阳离子电荷平衡的原理:n(NH4+)+3n(Al3+)=2n(SO42-)可得:n(A13+)=![]() =0.1mol,n(H2O)=
=0.1mol,n(H2O)=![]() ,所以该结晶水合物中:n(NH4+):n(A13+):n(SO42-):n(H2O)=0.1mol:0.1mol:0.2mol:1.2mol=1:1:2:12,该结晶水合物的化学式为NH4Al(SO4)212H2O,故答案为:NH4Al(SO4)212H2O;
,所以该结晶水合物中:n(NH4+):n(A13+):n(SO42-):n(H2O)=0.1mol:0.1mol:0.2mol:1.2mol=1:1:2:12,该结晶水合物的化学式为NH4Al(SO4)212H2O,故答案为:NH4Al(SO4)212H2O;
(3)加入Ba(OH)2溶液沉淀物质的量最大,此时Al3+、Ba2+沉淀完全,则n(Ba(OH)2)= n(SO42-)==0.2mol,则V(Ba(OH)2)=![]() = 100mL,故答案为:100;
= 100mL,故答案为:100;
(4)根据反应的先后顺序,开始阶段是氢氧化钠和铝离子反应生成氢氧化铝沉淀,钡离子和硫酸根生成硫酸钡沉淀,当n(Ba(OH)2)=![]() 时,Al3+沉淀完全, 此时V(Ba(OH)2)=
时,Al3+沉淀完全, 此时V(Ba(OH)2)=![]() ,沉淀的总物质的量为:0.1mol+0.15mol=0.25mol;之后沉淀继续增加的为硫酸钡沉淀,达到最大值时,V(Ba(OH)2)=
,沉淀的总物质的量为:0.1mol+0.15mol=0.25mol;之后沉淀继续增加的为硫酸钡沉淀,达到最大值时,V(Ba(OH)2)=![]() = 100mL,沉淀的总物质的量为0.1mol+0.2mol=0.3mol;最后是氢氧化铝和氢氧化纳反应生成偏铝酸钠的阶段,此时消耗的V(Ba(OH)2)=
= 100mL,沉淀的总物质的量为0.1mol+0.2mol=0.3mol;最后是氢氧化铝和氢氧化纳反应生成偏铝酸钠的阶段,此时消耗的V(Ba(OH)2)=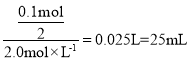 ,最后剩余0.2mol硫酸钡沉淀保持不变,如图示:
,最后剩余0.2mol硫酸钡沉淀保持不变,如图示:
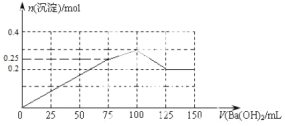 。
。


科目:高中化学 来源: 题型:
【题目】[实验化学]
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的_________。
②萃取用到的分液漏斗使用前需_______并洗净,分液时有机层在分液漏斗的_____填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是______________;用饱和食盐水洗涤的目的是______________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是_____(填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先_______,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如下图所示(a、b为石墨电极).下列说法中,正确的是
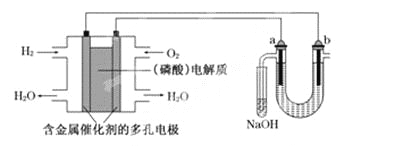
A. 电池工作时,正极反应式为: O2+2H2O+4e-===4OH-
B. 电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
C. 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D. 忽略能量损耗,当电池中消耗0.02 g H2时,b极周围会产生0.04 g H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu组成的原电池示意图,某小组做完该实验后,在读书卡片上作了如下记录,其中合理的是 ( )
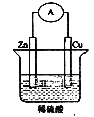
实验记录:①导线中电流方向:锌→铜②铜极上有气泡产生③锌片变薄
实验结论:④Zn为正极,Cu为负极⑤铜比锌活泼⑥H+向铜片移动
A.①②③B.④⑤⑥C.③④⑤D.②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环丁基甲酸(![]() )是有机合成中一种重要的中间体。实验室以链状分子A为原料合成环丁基甲酸的路线如下:
)是有机合成中一种重要的中间体。实验室以链状分子A为原料合成环丁基甲酸的路线如下:
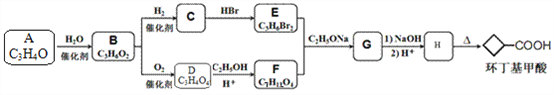
已知: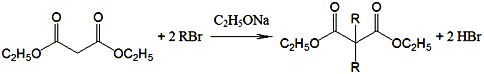
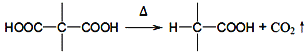
请回答下列问题:
(1)化合物A的化学名称是______,由A生成B的反应类型是_______。
(2)化合物B中所含官能团的名称为___________。
(3)化合物C和D反应所形成高聚物的结构简式是___________。
(4)写出E+F→G的化学方程式: ___________。
(5)X是环丁基甲酸的同分异构体,能与饱和碳酸氢钠溶液反应放出气体,且能使溴水褪色,X共有______种;其中核磁共振氢谱为三组峰,峰面积比为6:1:1的结构简式为___________。
(6)写出用1,3一丁二烯和化合物F为原料制备环戊基甲酸的合成路线___________。(其他试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知对于电离常数为Ka的某一元弱酸滴定过程中,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20 mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法不正确的是( )
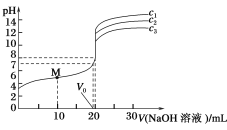
A.由图可知,c1>c2>c3
B.M点溶液中存在:c(H+)+c(HA)=c(OH-)+c(A-)
C.恰好中和时,溶液中离子浓度的大小关系:c(Na+)>c(A-)>c(OH-)>c(H+)
D.由pH=7的溶液计算得:Ka=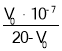 (V0是消耗的NaOH溶液的体积)
(V0是消耗的NaOH溶液的体积)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用废弃旧电池的铜帽(主要成分为Zn和Cu)回收Cu并制备ZnO的部分实验过程如图所示:

下列叙述错误的是( )
A. “溶解”操作中可用酸性条件下不断鼓入O2代替H2O2
B. 铜帽溶解后,将溶液加热至沸腾以除去溶液中过量的H2O2
C. 与加入锌粉反应的离子为Cu2+、H+
D. “过滤”操作后,将滤液蒸干、高温灼烧即可制取纯净的ZnO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为
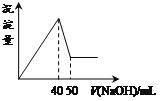
A.1:3B.1:2C.1:1D.2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl是我们生活中必不可少的物质。将NaCl溶于水配成1 mol/L的溶液,溶解过程如图所示,下列说法正确的是
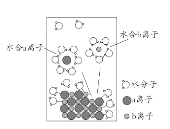
A.a离子为Na+
B.溶液中存在NaCl![]() Na++Cl-
Na++Cl-
C.溶液中含有NA个水合Na+和NA个水合Cl-
D.在水分子的作用下,NaCl溶解的同时发生了电离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com