
【题目】用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如下图所示(a、b为石墨电极).下列说法中,正确的是
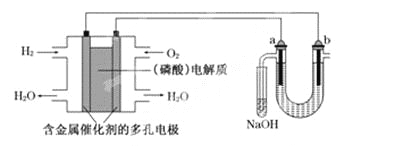
A. 电池工作时,正极反应式为: O2+2H2O+4e-===4OH-
B. 电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
C. 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D. 忽略能量损耗,当电池中消耗0.02 g H2时,b极周围会产生0.04 g H2
科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁((C6H11O7)2Fe)是常用的补铁剂,易溶于水,几乎不溶于乙醇。葡萄糖酸亚铁的制备方法之一是由新制备的碳酸亚铁(白色固体,微溶于水)与葡萄糖酸反应而制得,其流程如下:
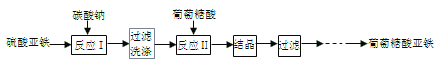
(1)用下图装置制备FeCO3
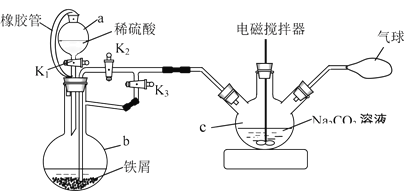
①仪器b的名称为_________。仪器a中橡胶管的作用是_______。
②反应开始时,先打开活塞K1和K3,关闭K2,目的是_______。一段时间后,关闭_______,打开______,目的是_______。
③将制得的FeCO3过滤、洗涤。检验沉淀已经洗涤干净的试剂为______(若多种试剂,按试剂使用由先到后的顺序填写)。
④用NaHCO3溶液代替Na2CO3溶液制备碳酸亚铁,同时有气体产生,反应的离子方程式为________。
(2)反应II中加入过量葡萄糖酸使溶液显弱酸性,原因是________。
(3)葡萄糖酸亚铁结晶时需加入乙醇,目的是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )

A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-4,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断中正确的是( )
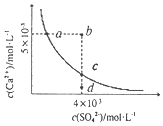
A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B.向d点溶液中加入适量CaCl2固体可以变到c点
C.a点对应的Ksp不等于c点对应的Ksp
D.b点将有沉淀生成,平衡后溶液中c(SO42-)=3×10-3mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Li、Fe、As均为重要的合金材料,NA为阿伏加德罗常数的值。回答下列问题:
(1)基态Li原子核外电子占据的空间运动状态有________个,占据最高能层电子的电子云轮廓图形状为_________。
(2)Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因为_________。
(3)基态Fe3+比基态Fe2+稳定的原因为____________。
(4)KSCN和K4[Fe(CN)6]均可用于检验Fe3+。
①SCN-的立体构型为_______,碳原子的杂化方式为_____________。
②K4[Fe(CN)6]中所含元素的第一电离能由大到小的顺序为__________(用元素符号表示);1 mol [Fe(CN)6]4-中含有σ键的数目为____________。
(5)H3AsO3的酸性弱于H3AsO4的原因为____________________。
(6)Li、Fe和As可组成一种新型材料,其立方晶胞结构如图所示。若晶胞参数为a nm,阿伏加德罗常数的值为NA,则该晶体的密度可表示为______g●cm-3。(列式即可)
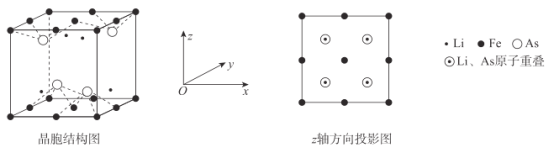
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为 45.3g 的该结晶水合物,分别制成溶液向其中一份逐滴加入 NaOH 溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出, 该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到 2.24L 该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入 Ba(OH)2 溶液,开始现象类似,但最终仍有白色沉淀; 过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体 46.6g。
请回答以下问题:
(1)该结晶水合物中含有的两种阳离子是_____和_____,阴离子是_____;
(2)试通过计算确定该结晶水合物的化学式。写出计算过程:_____假设过程中向该溶液中加入的 Ba(OH)2 溶液的物质的量浓度为 2.0molL1 。
(3)加入_____mLBa(OH)2 溶液时,所得沉淀的总物质的量最大。
(4)请在如图中画出生成沉淀的物质的量与加入 Ba(OH)2 溶液体积的关系示意图_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含有A+、B3+、C3+ 三种金属阳离子的水溶液发生了如下一系列变化后逐一沉淀出来,其中B3+转入白色沉淀:
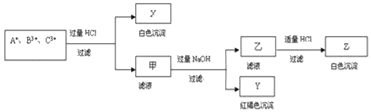
请通过分析回答(用化学符号填写):
(1)A+是__,B3+是__,C3+是__;
(2)X是__,Y是__,Z是__;
(3)写出下列离子方程式:
①生成Y沉淀:__;②B3+与过量氨水反应:__;
(4)写出下列化学方程式:单质铝和Y分解后的固体产物反应:__.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com