
【题目】Li、Fe、As均为重要的合金材料,NA为阿伏加德罗常数的值。回答下列问题:
(1)基态Li原子核外电子占据的空间运动状态有________个,占据最高能层电子的电子云轮廓图形状为_________。
(2)Li的焰色反应为紫红色,很多金属元素能产生焰色反应的原因为_________。
(3)基态Fe3+比基态Fe2+稳定的原因为____________。
(4)KSCN和K4[Fe(CN)6]均可用于检验Fe3+。
①SCN-的立体构型为_______,碳原子的杂化方式为_____________。
②K4[Fe(CN)6]中所含元素的第一电离能由大到小的顺序为__________(用元素符号表示);1 mol [Fe(CN)6]4-中含有σ键的数目为____________。
(5)H3AsO3的酸性弱于H3AsO4的原因为____________________。
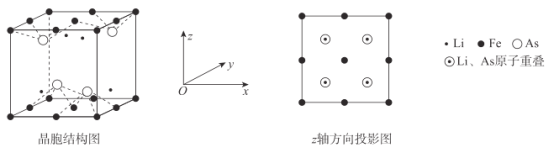
(6)Li、Fe和As可组成一种新型材料,其立方晶胞结构如图所示。若晶胞参数为a nm,阿伏加德罗常数的值为NA,则该晶体的密度可表示为______g●cm-3。(列式即可)
【答案】2 球形 电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,以光的形式释放能量 基态Fe2+的价层电子排布式为3d6,而基态Fe3+的价层电子排布式为3d5,为半充满状态,稳定性更强 直线形 sp N>C>Fe>K 12NA H3AsO3中非羟基氧原子数小于H3AsO4,砷元素的正电性更小,羟基更不易电离出氢离子 ![]()
【解析】
(1)根据构造原理书写Li核外电子排布式,据此书写基态Li原子核外电子占据的空间运动状态,据此判断Li原子核外占据最高能层电子的电子云轮廓图形状;
(2)焰色反应是是电子跃迁的结果;
(3)原子核外各个轨道电子排布处于全满、半满或全空时是稳定状态;
(4)①根据价层电子对分析,在SCN-中C原子形成了共价三键,据此判断C原子杂化类型;
②元素吸引电子能力越大,其电离能就越大;根据配位体及配位原子中含有的σ键计算;
(5)根据物质中含有的非羟基O原子数目分析;
(6)先根据均摊方法计算一个晶胞中含有的各种元素的原子个数然后根据ρ=![]() 计算密度。
计算密度。
(1)Li核外电子排布式是1s22s1,1个原子轨道为1个空间运动状态,基态Li原子核外电子占据的轨道有1s、2s两个,故有2个空间运动状态。占据最高能层为L层2s轨道,故电子云轮廓图形状为球形;
(2)金属元素产生焰色反应的原因为电子从较高能级的激发态跃迁到较低能级的激发态乃至基态时,以光的形式释放多余的能量,形成焰色反应,不同金属元素的电子跃迁时释放的能量不同,因此焰色反应不同;
(3)基态Fe3+的价层电子排布式为3d5,为d轨道的半充满的稳定状态,相对稳定形强,而基态Fe2+的价层电子排布式为3d6,稳定性不如半充满状态;
(4)①SCN-中C原子的价层电子对数目为2,立体构型为直线形,其中碳原子的杂化方式为sp;
②K4[Fe(CN)6]中基态K、Fe、C、N原子吸引电子能力依次增强,第一电离能依次增大;所以四种元素的第一电离能由大到小的顺序为N>C>Fe>K ;Fe2+与CN-形成配位键含6个σ键,每1个CN-中含有1个σ键,所以1mol[Fe(CN)6]4-中含有σ键的数目为12NA;
(5)H3AsO3中非羟基氧原子数是0,而H3AsO4中非羟基氧原子数是1,可见H3AsO3中非羟基氧原子数小于H3AsO4,酸分子中非羟基O原子数目越大,该酸的酸性就越强,且非羟基氧原子数少的酸分子中砷元素的正电性更小,羟基更不易电离出氢离子,故酸性弱于H3AsO4;
(6)由图可知,每个晶胞中含有4个Li、4个As、4个Fe,则该晶体的密度可表示为ρ=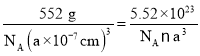 g/cm3。
g/cm3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】SiO2晶体的部分结构如图所示,关于该晶体下列说法错误的是( )

A.Si原子杂化类型为sp3
B.Si、O的原子个数比为1:4
C.Si原子数目与Si—O键数目比为1:4
D.SiO2晶体中最小环为12元环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳元素不仅能形成丰富多彩的有机化合物,而且还能形成多种无机化合物,同时自身可以形成多种单质,碳及其化合物的用途广泛。
(1)![]() 分子的晶体中,在晶胞的顶点和面心均含有一个
分子的晶体中,在晶胞的顶点和面心均含有一个![]() 分子,则一个
分子,则一个![]() 晶胞的质量为_______。
晶胞的质量为_______。
(2)干冰和冰是两种常见的分子晶体,下列关于两种晶体的比较中正确的是_____(填字母)。
a.晶体的熔点:干冰>冰
b.晶体中的空间利用率:干冰>冰
c.晶体中分子间相互作用力类型相同
(3)金刚石和石墨是碳元素形成的两种常见单质,下列关于这两种单质的叙述中正确的是______(填字母)。
a.金刚石中碳原子的杂化类型为![]() 杂化,石墨中碳原子的杂化类型为
杂化,石墨中碳原子的杂化类型为![]() 杂化
杂化
b.晶体中共价键的键长:金刚石中![]() <石墨中
<石墨中![]()
C.晶体的熔点:金刚石>石墨
d.晶体中共价键的键角:金刚石>石墨
e.金刚石晶体中只存在共价键,石墨晶体中则存在共价键、金属键和范德华力
f.金刚石和石墨的熔点都很高,所以金刚石和石墨都是原子晶体
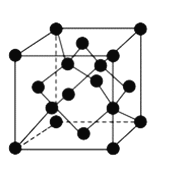
(4)金刚石晶胞结构如下图,立方![]() 结构与金刚石相似,在
结构与金刚石相似,在![]() 晶体中,
晶体中,![]() 原子周围最近的
原子周围最近的![]() 原子所构成的立体图形为_______,
原子所构成的立体图形为_______,![]() 原子与
原子与![]() 原子之间共价键与配位键的数目比为_______,一个晶胞中
原子之间共价键与配位键的数目比为_______,一个晶胞中![]() 原子数目为___________。
原子数目为___________。
(5)已知![]() 单质的晶体密度为
单质的晶体密度为![]() ,
,![]() 的相对原子质量为
的相对原子质量为![]() ,阿伏加德罗常数为
,阿伏加德罗常数为![]() ,则
,则![]() 的原子半径为_________。
的原子半径为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,有科研工作者提出可用如图所示装置进行水产养殖用水的净化处理。该装置工作时,下列说法错误的是
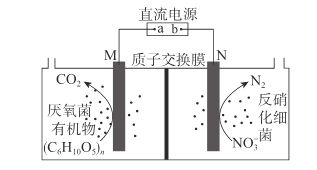
A.导线中电子由M电极流向a极
B.N极的电极反应式为2NO3-+10e-+12H+=N2↑+6H2O
C.当电路中通过24 mol电子的电量时,理论上有1 mol (C6H10O5)n参加反应
D.当生成1 mol N2时,理论上有10 mol H+通过质子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如下图所示(a、b为石墨电极).下列说法中,正确的是
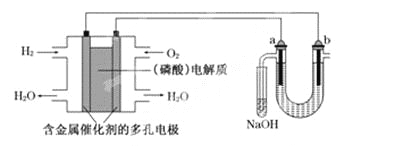
A. 电池工作时,正极反应式为: O2+2H2O+4e-===4OH-
B. 电解时,a电极周围首先放电的是Br-而不是Cl-,说明当其他条件相同时前者的还原性强于后者
C. 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D. 忽略能量损耗,当电池中消耗0.02 g H2时,b极周围会产生0.04 g H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度(molL-1) | NaOH物质的量浓度(molL-1) | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,用a来说明HA是强酸还是弱酸___。
(2)不考虑其它组的实验结果,单从乙组情况分析,c是否一定等于0.2___(选填“是”或“否”).混合液中离子浓度c(A-)与c(Na+)的大小关系是___。
(3)丙组实验结果分析,HA是___酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是___。
(4)丁组实验所得混合溶液中由水电离出的c(OH-)=___molL-1。写出该混合溶液中下列算式的精确结果(不能做近似计算)
c(Na+)-c(A-)=__molL-1
c(OH-)-c(HA)=__molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Zn和Cu组成的原电池示意图,某小组做完该实验后,在读书卡片上作了如下记录,其中合理的是 ( )
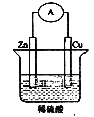
实验记录:①导线中电流方向:锌→铜②铜极上有气泡产生③锌片变薄
实验结论:④Zn为正极,Cu为负极⑤铜比锌活泼⑥H+向铜片移动
A.①②③B.④⑤⑥C.③④⑤D.②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知对于电离常数为Ka的某一元弱酸滴定过程中,pH突变随其浓度的增大而增大,且浓度主要影响滴定终点和滴定终点之后的曲线部分。常温下,用不同浓度的NaOH溶液分别滴定20 mL与其同浓度的某弱酸HA溶液,滴定曲线如图所示。下列说法不正确的是( )
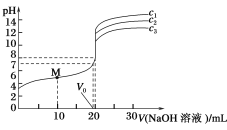
A.由图可知,c1>c2>c3
B.M点溶液中存在:c(H+)+c(HA)=c(OH-)+c(A-)
C.恰好中和时,溶液中离子浓度的大小关系:c(Na+)>c(A-)>c(OH-)>c(H+)
D.由pH=7的溶液计算得:Ka=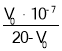 (V0是消耗的NaOH溶液的体积)
(V0是消耗的NaOH溶液的体积)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚烷具有类似樟脑气味的无色晶体,其衍生物在医药方面有着重要的用途。以化合物X为起始原料没生一系列反应制得金刚烷(Z)的过程如图所示,下列说法不正确的是

A. X的分子式为C10H12
B. X生成Y的反应为还原反应
C. Y和Z互为同分异构体
D. Z和环已烷属于同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com