
����Ŀ�������Dz��ֶ������еڶ�����������Ԫ�ص�ԭ�Ӱ뾶����Ҫ���ϼۣ�
Ԫ�ش��� | �� | �� | �� | �� | �� | �� | �� | �� |
ԭ�Ӱ뾶��nm�� | 0.186 | 0.160 | 0.152 | 0.153 | 0.110 | 0.099 | 0.075 | 0.074 |
��Ҫ���ϼ� | +1 | +2 | +1 | +3 | +5�� | +7�� | +5�� | ��2 |
�ش��������⣺
��1��д�����ǵ�Ԫ�����ƣ�����������������
��2������Ԫ�����ڱ��е�λ���ǣ����ڡ��壩
��3��8��Ԫ�ص�����������ˮ�����У�������ǿ�������ѧʽ����
��4����Ԫ�غ͢�Ԫ���γɻ�����ĵ���ʽ�� ��
��5��д��������������Ӧˮ��������⻯��ˮ��Һ��Ӧ�����ӷ���ʽ�� ��
��6������������ȷ����������ĸ���� A���ۡ��ܴ��ڲ�ͬ����
B���ڵ����������������ӵĺ�����������
C������ͬ����Ԫ���зǽ�������ǿ
D����Ԫ�����Ԫ�����ߺ˵����֮����8
E��������γɵĻ�����������ԣ�
���𰸡�
��1��Na��Mg��Li��Al��P��Cl��N��O
��2���ڶ�����VIA��
��3��HClO4
��4��![]()
��5��Al��OH��3+3H+=Al3++3H2O
��6��A��B��D
���������⣺��1���ڶ���������Ԫ���У��٢۾���+1�ۣ�����IA�壬ԭ�Ӱ뾶�٣��ۣ����ΪNa����ΪLi���ݢ߾���+5����3�ۣ�ԭ�Ӱ뾶�ݣ��ߣ����ΪPԪ�ء���ΪNԪ�أ�����+2�ۣ����ڢ�A�壬ԭ�Ӱ뾶����P���ʢ�ΪMg������+3�ۣ����ڢ�A�壬ԭ�Ӱ뾶����P���ʢ�ΪAl������+7����1�ۣ����ΪCl�����Щ�2�ۣ�����VIA�壬ԭ�Ӱ뾶С���ȣ��ʢ�ΪOԪ�أ� ���Դ��ǣ�Na��Mg��Li��Al��P��Cl��N��O����2����ΪOԪ�أ���Ԫ�����ڱ��е�λ���ǣ��ڶ�����VIA�壬
���Դ��ǣ��ڶ�����VIA�壻��3��8��Ԫ�ص�����������ˮ�����У�������ǿ����HClO4 ��
���Դ��ǣ�HClO4����4����Ԫ�غ͢�Ԫ���γɻ�����ΪNaCl������ʽ�� ![]() ��
��
���Դ��ǣ� ![]() ����5��������������Ӧˮ����ΪAl��OH��3 �� ���⻯��ˮ��ҺΪ���ᣬ���߷�Ӧ�����ӷ���ʽ��Al��OH��3+3H+=Al3++3H2O��
����5��������������Ӧˮ����ΪAl��OH��3 �� ���⻯��ˮ��ҺΪ���ᣬ���߷�Ӧ�����ӷ���ʽ��Al��OH��3+3H+=Al3++3H2O��
���Դ��ǣ�Al��OH��3+3H+=Al3++3H2O����6��A����ΪLi�����ڵڶ����ڣ���ΪAl�����ڵ������ڣ���A��ȷ��
B���ڵ������Ӻ��������Ϊ10����������ӵĺ��������Ϊ10����B��ȷ��
C����ͬ����Ԫ����FԪ�طǽ����Ա�Cl��ǿ����C����
D����ΪPԪ�ء���ΪNԪ�أ����ߺ˵����֮����8����D��ȷ��
E��������γɵĻ�����Ϊ�����ơ��������ƣ����������������E����
��ѡ��ABD��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪X��Y��Z��E��F���ֳ������ʺ���ͬһԪ��M����һ����������������ͼת����ϵ��Z��NO�������ƶϲ��������ǣ� �� 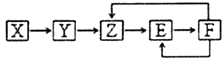
A.X������һ���⻯��
B.X����Zһ���ǻ��Ϸ�Ӧ
C.E������һ����ɫ����
D.F��MԪ�صĻ��ϼۿ���Ϊ+5
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����п������õİ�ͷ����������H�ĺϳ�·������ͼ��ʾ��

��֪��
![]()
(1)A���ڷ���������������___________________��
(2)B�Ľṹ��ʽ��____________________________��
(3)��C����D�Ļ�ѧ����ʽ��___________________________________________��
(4)��E��I2��һ�������·�Ӧ����F�Ļ�ѧ����ʽ��____________________________���˷�Ӧͬʱ��������һ���л�����������F��Ϊͬ���칹�壬���л�������Ľṹ��ʽ��_____________________________________��
(5)�Լ�b��_____________________________��
(6)����˵����ȷ����___________��ѡ����ĸ��ţ���
a. G����˳���칹��
b. ��G����H�ķ�Ӧ�Ǽӳɷ�Ӧ
c. 1 mol G��������1 mol H2�����ӳɷ�Ӧ
d. 1 mol F��1 mol H������NaOH��Һ��Ӧ��������2 molNaOH
(7)����ϩΪ��ʼԭ�ϣ������֪��Ϣѡ�ñ�Ҫ�����Լ��ϳɣ�д���ϳ� ��·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ������_______��
��·�ߣ��ýṹ��ʽ��ʾ�л���ü�ͷ��ʾת����ϵ����ͷ��ע���Լ��ͷ�Ӧ������_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���10 mL 0.40 mol��L-1 H2O2��Һ�м�������FeCl3��Һ����ͬʱ�̲������O2�������������Ϊ��״�������±���ʾ��
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
������ʾ����Ӧ���������У�
��2Fe3++ H2O2 ![]() 2Fe2++O2��+2H+
2Fe2++O2��+2H+
�� H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
��Ӧ�����������仯����ͼ��ʾ������˵������ȷ����

A. 0��6 min��ƽ����Ӧ���ʣ�v(H2O2) = 3.33��10-2 mol��L-1��min-1
B. Fe3+�������Ǽӿ��������ķֽ�����
C. ��Ӧ�������ȷ�Ӧ����Ӧ���Ƿ��ȷ�Ӧ
D. ��Ӧ2H2O2(aq)![]() 2H2O(l) + O2(g)�ġ�H =E1-E2 < 0
2H2O(l) + O2(g)�ġ�H =E1-E2 < 0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ����Ҫ���л�����ԭ�ϣ���Ҫ���������۱�ϩ����ϩ�桢��������ȡ�
��1���Զ�ϩ����ϩΪԭ���Ʊ���ϩ�ķ�������Ϊ��ϩ���绯��"����Ҫ��ӦΪC4H8(g)+C2H4(g)![]() 2C3H6(g)
2C3H6(g)
��֪���ȼ�������ݣ�
C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ��H1=-1411kJ��mol-1
C3H6(g)+ ![]() O2(g)=3CO2(g)+3H2O(l) ��H2=-2049kJ��mol-1
O2(g)=3CO2(g)+3H2O(l) ��H2=-2049kJ��mol-1
C4H8(g)+6O2(g)=4CO2(g)+4H2O(l) ��H3=-2539kJ��mol-1
����ϩ�ĵ���ʽΪ______________��
����ͬ������C2H4(g)��C3H6(g)��C4H8(g)���ȼ�գ��ų��������ɶൽ�ٵ�˳������Ϊ______________����д��ѧʽ����
�� ������ϩ���绯�����ķ�Ӧ���Ȼ�ѧ����ʽΪ___________��
��2������ϩ�ѽⷨ������һ����Ҫ�ı�ϩ�����������������л���������ϩ�ĸ���Ӧ������
��Ӧ���£�����Ӧ��3C4H8![]() 4C3H6������Ӧ��C4H8
4C3H6������Ӧ��C4H8![]() 2C2H4
2C2H4
�����������Ӧ��ƽ����ϵ�У�����ֵ�����������w%)���¶���T����ѹǿ��p)�仯�����Ʒֱ���ͼ1��ͼ2��ʾ��

��ƽ����ϵ�еı�ϩ����ϩ��������[![]() ]�ǹ�ҵ������ϩʱѡ��Ӧ��������Ҫָ��֮һ���Ӳ���Ĵ��ȿ��ǣ�����ֵԽ��Խ�ã���ͼ1��ͼ2�б��ֵ��������������з�Ӧ���������˵���_____������ĸ��ţ�
]�ǹ�ҵ������ϩʱѡ��Ӧ��������Ҫָ��֮һ���Ӳ���Ĵ��ȿ��ǣ�����ֵԽ��Խ�ã���ͼ1��ͼ2�б��ֵ��������������з�Ӧ���������˵���_____������ĸ��ţ�
A. 300�� 0.1MPa B. 700�� 0.1MPa
C.300�� 0.5MPa D.700�� 0.5MPa
�����о��߽��ͼ1���ݲ��ۺϿ��Ǹ������أ���Ϊ450���ķ�Ӧ�¶ȱ�300����700�������ʣ��ӷ�Ӧԭ���Ƕȷ��������ɿ�����__________��
��ͼ2�У���ѹǿ����ƽ����ϵ�б�ϩ�������������������ƣ���ƽ��ǶȽ�����ԭ����_________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ����ᡢ����������ͿƼ���������ء������й�˵����ȷ����
A.̼�����׳ƽ��ɰ��������ɰֽ��ɰ�ֵ�ĥ��
B.���칬���š�ʹ�õ�̼��ά����һ�������л��߷��Ӳ���
C.����β���к��еĵ�����������Ͳ���ȫȼ����ɵ�
D.ʯ���ǻ�����ͨ������õ����͡�ú�͵ȴ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦN2O4��g��![]() 2NO2��g����H����57 kJ��mol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯��������ͼ��ʾ������˵����ȷ����
2NO2��g����H����57 kJ��mol��1�����¶�ΪT1��T2ʱ��ƽ����ϵ��NO2�����������ѹǿ�仯��������ͼ��ʾ������˵����ȷ����

A��a��c����ķ�Ӧ���ʣ�a��c
B��a��c�����������ɫ��a�cdz
C��a��b���������ƽ����Է���������a��b
D��b��c���㻯ѧƽ�ⳣ����b��c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£��ס��ҡ�������������̬���ķ����������������ֱ�Ϊ10��14��16��18�����й�����������̬�����ƶ���ȷ����
A. ������̬�������������ֻ�Ϊͬ���칹��
B. ���������Ը��������Һ�����Һͱ�
C. ������������ԭ�Ӿ���ͬһƽ����
D. �ҺͶ�����ͬϵ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com