
【题目】天然气燃烧是天然气应用的重要途径。下列有关说法正确的是( )
A.一定温度下,反应![]() 能自发进行,该反应的
能自发进行,该反应的![]()
B.甲烷氧气碱性燃料电池的负极反应为![]()
C.常温常压下,甲烷氧气燃料电池放电过程中消耗![]() ,转移电子的数目为
,转移电子的数目为![]()
D.加入催化剂可使![]() 的
的![]() 减小
减小
科目:高中化学 来源: 题型:
【题目】水的电离过程为H2O![]() H++OH-,在不同温度下其平衡常数为:K(25℃)=1.0×10-14, K(35℃)=2.1×10-14,则下列叙述正确的是
H++OH-,在不同温度下其平衡常数为:K(25℃)=1.0×10-14, K(35℃)=2.1×10-14,则下列叙述正确的是
A. c(H+)随温度的升高而降低B. 在35℃时,c(H+)>c(OH-)
C. 水的电离度α(25℃)>α(35℃)D. 水的电离是吸热的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
(1)把与下面元素有关性质相符的曲线标号填入相应的空格中:
a. 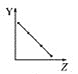 b.
b. 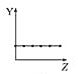 c.
c. 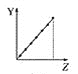 d.
d. 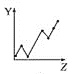
①第ⅡA族元素的价电子数________。
②第三周期元素的最高化合价________。
③F-、Na+、Mg2+、Al3+的离子半径________。
(2)元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M元素原子的最外层电子数与电子层数之比为4∶3;N-、Z+、X+的半径逐渐减小;化合物XN常温下为气体。据此回答:
①X为___________(名称),Y为____________(元素符号),Z原子结构示意图为________________。
②N的最高价氧化物的水化物的化学式为________________。
③M的最高价氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应m A(s)+n B(g) ![]() e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是( )
e C(g)+f D(g),反应过程中,当其他条件不变时,C的体积分数φ(C)在不同温度和不同压强的条件下随时间的变化如图所示。下列叙述正确的是( )
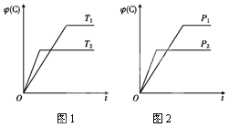
A.平衡后,若使用催化剂,C的体积分数将增大
B.平衡后,若温度升高,化学平衡向正反应方向移动
C.平衡后,增加A的质量化学平衡向正反应方向移动
D.化学方程式中,化学计量数的关系为n<e +f
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室探究制备高锰酸钾的绿色化方案,其实验流程如下:
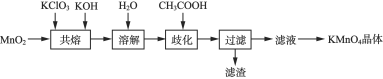
已知:![]() 水溶液呈墨绿色,在酸性、中性和弱碱性环境下,
水溶液呈墨绿色,在酸性、中性和弱碱性环境下,![]() 会发生自身氧化还原(歧化)反应,生成
会发生自身氧化还原(歧化)反应,生成![]() 和
和![]() ;部分试剂熔点、分解温度见下表:
;部分试剂熔点、分解温度见下表:
物质 |
|
|
|
|
|
熔点/ | 406 | 368 | —— | —— | —— |
分解温度/ | 1323 |
| 530 | 190 | 240 |
(1)在强碱性条件下,![]() 与
与![]() 共熔可制得
共熔可制得![]() ,其化学方程式为________。投料的顺序为先加入
,其化学方程式为________。投料的顺序为先加入![]() 和
和![]() 混合均匀,待小火完全熔融,再加入
混合均匀,待小火完全熔融,再加入![]() ,迅速搅拌。不能先将
,迅速搅拌。不能先将![]() 与
与![]() 混合的原因是________。
混合的原因是________。
(2)溶解后所得溶液转入三颈瓶中,趁热滴入![]() 的乙酸,调节
的乙酸,调节![]() ,在如下图所示的装置中进行歧化。
,在如下图所示的装置中进行歧化。
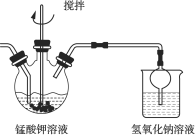
①该步骤中如果pH控制过高,可能会导致________。
②判断三颈瓶中![]() 完全反应的实验方法是:用玻璃棒蘸取溶液点在滤纸上,若观察到________,表示
完全反应的实验方法是:用玻璃棒蘸取溶液点在滤纸上,若观察到________,表示![]() 已完全反应。
已完全反应。
(3)从提高原料利用率的角度分析,本实验流程的优点是________________。
(4)设计以滤液为原料,制取![]() 晶体的实验方案:________________(已知
晶体的实验方案:________________(已知![]() 在水溶液中,
在水溶液中,![]() 以上开始分解。实验中必须使用的设备:蒸发皿、恒温水浴槽、恒温干燥箱)。
以上开始分解。实验中必须使用的设备:蒸发皿、恒温水浴槽、恒温干燥箱)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的恒容密闭容器中,用CO2和H2在催化剂的作用下合成甲醇,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),将1molCO2和3molH2在装有催化剂的反应器中反应8小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如下图所示。下列说法正确的是( )
CH3OH(g)+H2O(g),将1molCO2和3molH2在装有催化剂的反应器中反应8小时。体系中甲醇的产率和催化剂的催化活性与温度的关系如下图所示。下列说法正确的是( )
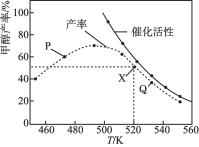
A.反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)的△H>0
CH3OH(g)+H2O(g)的△H>0
B.图中P点所示条件下,延长反应时间能提高CH3OH的产率
C.图中Q点所示条件下,增加CO2的浓度可提高H2转化率
D.![]() 下,X点所对应甲醇的产率为50%,则平衡常数K=0.15
下,X点所对应甲醇的产率为50%,则平衡常数K=0.15
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸锌是一种常见的补锌药物,常用葡萄糖酸和![]() 反应制备。
反应制备。
(1)![]() 基态核外电子排布式为________。
基态核外电子排布式为________。
(2)![]() 的空间构型为________(用文字描述);
的空间构型为________(用文字描述);![]() 与
与![]() 反应能生成
反应能生成![]() ,不考虑空间构型,
,不考虑空间构型,![]() 的结构可用示意图表示为________。
的结构可用示意图表示为________。
(3)葡萄糖酸的分子结构如图1所示,分子中碳原子的轨道杂化类型为________;推测葡萄糖酸在水中的溶解性:________(填“难溶于水”或“易溶于水”)。
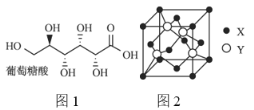
(4)用![]() 可以制备
可以制备![]() ,一个
,一个![]() 晶胞(如图2)中,
晶胞(如图2)中,![]() 的数目为________。
的数目为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应aA (g) + bB (s) ![]() cC (g) + dD (g)在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是( )
cC (g) + dD (g)在反应过程中,其他条件不变,C的物质的量分数和T或P关系如图所示,下列叙述中正确的是( )
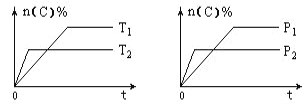
A. 温度降低,化学平衡向逆反应方向移动
B. 使用催化剂,C的物质的量分数增加
C. 化学方程式系数a <c+d
D. 无法根据图像确定改变温度后化学平衡移动方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知2SO2(g)+O2(g)![]() 2SO3(g) △H=-197 kJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2 和1 mol O2;(乙) 1 mol SO2 和0.5 mol O2;(丙) 2 mol SO3;恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3(g) △H=-197 kJ·mol-1,向同温、同体积的三个密闭容器中分别充入气体:(甲)2 mol SO2 和1 mol O2;(乙) 1 mol SO2 和0.5 mol O2;(丙) 2 mol SO3;恒温、恒容下反应达平衡时,下列关系一定正确的是
A. 若c(SO2)与c(O2)之比为k,则:k甲=k丙>k乙
B. 反应放出或吸收热量的数值Q:Q甲=Q丙>2Q乙
C. 容器内压强P:P甲=P丙>2P乙
D. SO3的质量m:m甲=m丙>2m乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com