
【题目】亚氯酸钠![]() 用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成
用于漂白织物、纤维、纸浆,具有对纤维损伤小的特点.其在溶液中可生成![]() 、
、![]() 、
、![]() 、
、![]() 等,其中
等,其中![]() 和
和![]() 都具有漂白作用.已知
都具有漂白作用.已知![]() ,经测定
,经测定![]() 时各组分含量随pOH变化情况如图所示
时各组分含量随pOH变化情况如图所示![]() 没有画出
没有画出![]() ,此温度下,下列分析正确的是
,此温度下,下列分析正确的是![]()
![]()

A.![]() 的电离平衡常数的数值
的电离平衡常数的数值![]()
B.亚氯酸钠在酸性条件下较稳定
C.![]() 时,溶液中含氯微粒的浓度大小为:
时,溶液中含氯微粒的浓度大小为:![]()
D.同浓度的![]() 溶液和
溶液和![]() 溶液等体积混合,则混合溶液中有
溶液等体积混合,则混合溶液中有![]()
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】如图用铜锌原电池(电解质溶液为稀硫酸)在铁棒上电镀铜,下列叙述正确的是( )

A. 铜在原电池中作负极,在电镀池中作阳极
B. 原电池溶液增加的质量比电镀池阴极增加的质量大
C. 锌棒每减少0.65 g,导线上转移的电子就为0.02 mol
D. 电镀池中的电解质溶液可用ZnSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的![]() 在恒压密闭容器中发生反应:
在恒压密闭容器中发生反应:![]() 。平衡时,体系中各气体体积分数与温度的关系如图所示:
。平衡时,体系中各气体体积分数与温度的关系如图所示:

(1).已知甲烷、碳、氢气的燃烧热分别为![]() 、
、![]() 、
、![]() ,则该反应的反应热
,则该反应的反应热![]() __________。
__________。
(2).下列能说明反应一定达到平衡状态的是_______。
![]() 和
和![]() 的体积分数相等
的体积分数相等
![]() 混合气体的平均相对分子质量不变
混合气体的平均相对分子质量不变
![]() 混合气体的密度不变
混合气体的密度不变
![]() 气体总压强不再变化
气体总压强不再变化
![]() 碳的质量不再改变
碳的质量不再改变
(3).![]() 时,若在平衡体系中充入惰性气体,此时反应速率____
时,若在平衡体系中充入惰性气体,此时反应速率____![]() 填“变大”、“变小”或“不变”
填“变大”、“变小”或“不变”![]() ,且
,且![]() _____
_____![]() 填“
填“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]() 。
。
(4).![]() 时,若在平衡体系中充入等体积的
时,若在平衡体系中充入等体积的![]() 和
和![]() ,则平衡_____移动,其理由是_______。
,则平衡_____移动,其理由是_______。
(5).![]() 时,反应达平衡后
时,反应达平衡后![]() 的转化率为____________。
的转化率为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10.00mL0.1000mol·L-1 HA溶液中逐滴加入0.1000mol·L-1NaOH溶液的pH与所加NaOH溶液体积的关系如图所示。下列说法不正确的是( )
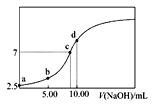
A.HA溶液的电离方程式为HA![]() H+ +A-
H+ +A-
B.恰好完全反应的点是c点
C.整个滴定过程中水的电离程度先增大后减小
D.点d所示溶液中:c(Na+)+c(H+)=c(OH-)+c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用![]() 溶液分别滴定
溶液分别滴定![]() 的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是
的盐酸和醋酸,滴定曲线如图所示。下列说法正确的是![]()
![]()

A.Ⅱ表示的是滴定醋酸的曲线
B.![]() 时,滴定醋酸消耗的
时,滴定醋酸消耗的![]() 小于
小于![]()
C.![]() 时,两份溶液中
时,两份溶液中![]()
D.![]() 时,醋酸溶液中
时,醋酸溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学键及晶体的说法中,正确的是
A.Cl2、Br2、I2的沸点逐渐升高,是因为键能越来越大
B.N2和CCl4两种分子中,每个原子的最外层都具有8电子稳定结构
C.金属钠的晶体采用简单立方堆积,每个晶胞含1个原子,配位数为6
D.石英晶体和干冰晶体熔沸点不同,是因为所含化学键类型不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液分别滴加到两种一元弱酸HA和HB中,两种混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是

A. 电离常数:Ka(HB)>Ka(HA)
B. Ka(HA)的数量级为10-5
C. 当HA与NaOH溶液混合至中性时:c(A-)=c(HA)
D. 等浓度等体积的HA和NaB混合后所得溶液中:c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是( )
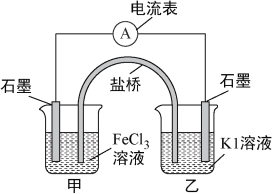
A. 反应开始时,乙中石墨电极上发生氧化反应
B. 反应开始时,甲中石墨电极上Fe3+被还原
C. 电流计读数为零时,反应达到化学平衡状态
D. 电流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种锂离子二次电池的总反应为FePO4(s)+ Li(s) ![]() LiFePO4(s)装置如图所示(a极材料为金属锂和石墨的复合材料)。下列说法不正确的是( )
LiFePO4(s)装置如图所示(a极材料为金属锂和石墨的复合材料)。下列说法不正确的是( )

A.图中e―及Li+的移动方向说明该电池处于放电状态
B.该电池中a极不能接触水溶液
C.充电时a极连接外接电源的正极
D.充电时,b极电极反应式为:LiFePO4–e―= Li+ + FePO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com