
����Ŀ��һ������![]() �ں�ѹ�ܱ������з�����Ӧ��
�ں�ѹ�ܱ������з�����Ӧ��![]() ��ƽ��ʱ����ϵ�и���������������¶ȵĹ�ϵ��ͼ��ʾ��
��ƽ��ʱ����ϵ�и���������������¶ȵĹ�ϵ��ͼ��ʾ��

(1).��֪���顢̼��������ȼ���ȷֱ�Ϊ![]() ��
��![]() ��
��![]() ����÷�Ӧ�ķ�Ӧ��
����÷�Ӧ�ķ�Ӧ��![]() __________��
__________��
(2).������˵����Ӧһ���ﵽƽ��״̬����_______��
![]() ��
��![]() ������������
������������
![]() ��������ƽ����Է�����������
��������ƽ����Է�����������
![]() ���������ܶȲ���
���������ܶȲ���
![]() ������ѹǿ���ٱ仯
������ѹǿ���ٱ仯
![]() ̼���������ٸı�
̼���������ٸı�
(3).![]() ʱ������ƽ����ϵ�г���������壬��ʱ��Ӧ����____
ʱ������ƽ����ϵ�г���������壬��ʱ��Ӧ����____![]() ���������������С������������
���������������������������![]() ����
����![]() _____
_____![]() ����
����![]() ������
������![]() ������
������![]() ��
��![]() ��
��
(4).![]() ʱ������ƽ����ϵ�г���������
ʱ������ƽ����ϵ�г���������![]() ��
��![]() ����ƽ��_____�ƶ�����������_______��
����ƽ��_____�ƶ�����������_______��
(5).![]() ʱ����Ӧ��ƽ���
ʱ����Ӧ��ƽ���![]() ��ת����Ϊ____________��
��ת����Ϊ____________��
���𰸡�![]()
![]() ��С
��С ![]() ���ƶ�
���ƶ� ![]() ��
��![]() ��Ũ�Ȳ���
��Ũ�Ȳ��� ![]()
��������
���⿼�鷴Ӧ�ȵļ��㣬��ѧƽ���ƶ�����ѧƽ��״̬���жϣ��Ѷ��еȡ�
(1).��֪���顢̼��������ȼ���ȷֱ�Ϊ![]() ��
��![]() ��
��![]() ������
������
![]() ��
��![]()
![]() ��
��
���ݸ�˹����![]() �õ�Ŀ�귽��ʽ��
�õ�Ŀ�귽��ʽ��
(2).![]() �����ݻ�ѧƽ���ֱ�Ӻͼ���ж������жϣ�
�����ݻ�ѧƽ���ֱ�Ӻͼ���ж������жϣ�
(3).���º�ѹ��������壬�൱�ڷ�Ӧ��Ũ�ȼ�С�����ʼ�С��ƽ�������ƶ���
(4).![]() ʱ������ƽ����ϵ�г���������
ʱ������ƽ����ϵ�г���������![]() ��
��![]() ����ƽ�ⲻ�ƶ�����Ϊ
����ƽ�ⲻ�ƶ�����Ϊ![]() ��
��![]() ��Ũ�Ȳ��䣻
��Ũ�Ȳ��䣻
(5).![]() ʱ���������������Ϊ�ٷ�֮��ʮ��������ʽ���㷴Ӧ��ƽ���
ʱ���������������Ϊ�ٷ�֮��ʮ��������ʽ���㷴Ӧ��ƽ���![]() ��ת���ʣ�
��ת���ʣ�
![]() ��֪���顢̼��������ȼ���ȷֱ�Ϊ
��֪���顢̼��������ȼ���ȷֱ�Ϊ![]() ��
��![]() ��
��![]() ������
������
![]() ��
��![]()
![]() ��
��
���ݸ�˹����![]() �ã�
�ã�![]()
![]() ����÷�Ӧ�ķ�Ӧ��
����÷�Ӧ�ķ�Ӧ��![]() ��
��
�ʴ�Ϊ��![]() ��
��
![]() ��
��![]() �����������ȣ�����˵����Ӧһ���ﵽƽ��״̬����a����
�����������ȣ�����˵����Ӧһ���ﵽƽ��״̬����a����
![]() ����̼Ϊ���壬�ҷ�Ӧǰ���������������ȣ���˻�������ƽ����Է����������䣬��˵����Ӧһ���ﵽƽ��״̬����b��ȷ��
����̼Ϊ���壬�ҷ�Ӧǰ���������������ȣ���˻�������ƽ����Է����������䣬��˵����Ӧһ���ﵽƽ��״̬����b��ȷ��
![]() ����̼Ϊ���壬���Ի��������ܶȲ��䣬��˵����Ӧһ���ﵽƽ��״̬����c��ȷ��
����̼Ϊ���壬���Ի��������ܶȲ��䣬��˵����Ӧһ���ﵽƽ��״̬����c��ȷ��
![]() ��Ϊ��Ӧ�ں�ѹ�����½��У�����������ѹǿ���ٱ仯������˵����Ӧһ���ﵽƽ��״̬����d����
��Ϊ��Ӧ�ں�ѹ�����½��У�����������ѹǿ���ٱ仯������˵����Ӧһ���ﵽƽ��״̬����d����
![]() ̼���������ٸı䣬��˵����Ӧһ���ﵽƽ��״̬����e��ȷ��
̼���������ٸı䣬��˵����Ӧһ���ﵽƽ��״̬����e��ȷ��
�ʴ�Ϊ��bce��
![]() ʱ����Ϊ��Ӧ�ں�ѹ�����½��У�����ƽ����ϵ�г���������壬�������Ӧ��Ũ�ȼ�С�����Է�Ӧ���ʱ�С��ƽ�������ƶ�����
ʱ����Ϊ��Ӧ�ں�ѹ�����½��У�����ƽ����ϵ�г���������壬�������Ӧ��Ũ�ȼ�С�����Է�Ӧ���ʱ�С��ƽ�������ƶ�����![]() ��
��
�ʴ�Ϊ����С��![]() ��
��
![]() ʱ������ƽ����ϵ�г���������
ʱ������ƽ����ϵ�г���������![]() ��
��![]() ����ƽ�ⲻ�ƶ�����Ϊ
����ƽ�ⲻ�ƶ�����Ϊ![]() ��
��![]() ��Ũ�Ȳ��䣻
��Ũ�Ȳ��䣻
�ʴ�Ϊ�����ƶ���![]() ��
��![]() ��Ũ�Ȳ��䣻
��Ũ�Ȳ��䣻
![]()
![]()
��ʼ(mol)
ת��(mol) x 2x
ƽ��(mol) ![]() 2x
2x
��![]() �����
�����![]() ������
������![]() ʱ����Ӧ��ƽ���
ʱ����Ӧ��ƽ���![]() ��ת����Ϊ
��ת����Ϊ![]() ��
��
�ʴ�Ϊ��![]() ��
��


 �ľ�ͼ���ʱ�ȷ�ϵ�д�
�ľ�ͼ���ʱ�ȷ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ϊ��ѹ��������Ϊ������������ͬ�����³�������ʵ���NO2���壬����ʼʱ�����ͬ��������Ӧ��2NO2(g) ![]() N2O4(g) ��H<0һ��ʱ�����̴ﵽƽ��״̬������˵������ȷ���ǣ� ��
N2O4(g) ��H<0һ��ʱ�����̴ﵽƽ��״̬������˵������ȷ���ǣ� ��

A.ƽ��ʱNO2�����������<��
B.�ұȼ��ȴﵽƽ��״̬
C.�÷�Ӧ��ƽ�ⳣ������ʽ![]()
D.NO2��ƽ��ת���ʣ���<��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(NH3��BH3)��ؿ��ڳ����¹�����װ����ͼ��ʾ��δ���백����֮ǰ��������������ȣ���ط�ӦΪNH3��BH3��3H2O2==NH4BO2��4H2O ����֪H2O2����������˵����ȷ����(����)

A. �����ĵ缫��ӦʽΪ2H����2e��===H2��
B. ��ع���ʱ��H��ͨ�����ӽ���Ĥ���ƶ�
C. ��ع���ʱ�����������ֱ�ų�H2��NH3
D. �����㹻��ʱ���������������������Ϊ1.9 g�����·��ת��0.6 mol����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.��Ӧ2CO(g)��O2(g)��2CO2(g)��һ�����������Է����е�ԭ������S��0
B.��Ksp[Mg(OH)2]��1.8��10��11��֪������pH��8����Һ�У�c(Mg2��)��1.8��10��5mol��L1
C.��ӦH2(g)��Cl2(g)��2HCl(g)����H������ʽ���㣺��H����Ӧ�ж��ѵľɻ�ѧ������֮�ͣ���Ӧ���γɵ��»�ѧ������֮��
D.�ɷ�ӦC(s)��1/2O2 (g)��CO(g)��H����111 kJ��mol1��֪C��ȼ������111 kJ��mol1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���˵����ȷ���ǣ�������
A. HCl��NaOH��Ӧ���к��ȡ�H=��57.3 kJ/mol����H2SO4��Ba(OH)2��Ӧ���к��ȡ�H=2��(��57.3) kJ/mol
B. ��֪C2H5OH(l)��ȼ������1366.8 kJ/mol����C2H5OH(l)+3O2(g) �T 2CO2(g)+3H2O(g) ��Ӧ�ġ�H=��1366.8 kJ/mol
C. һ��������2SO2(g)+O2(g)![]() 2SO3(g) ��H1<0��2SO2(g)+O2(g)
2SO3(g) ��H1<0��2SO2(g)+O2(g)![]() 2SO3(l) ��H2<0�����H1����H2
2SO3(l) ��H2<0�����H1����H2
D. ��һ���¶Ⱥ�ѹǿ�£���0.5mol N2��1.5 mol H2�����ܱ������г�ַ�Ӧ����NH3��g�����ų�����19.3 kJ�������Ȼ�ѧ����ʽΪN2(g)+3H2(g)![]() 2NH3(g) ��H=��38.6kJ/mol
2NH3(g) ��H=��38.6kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����淴Ӧ��2NO2(g)![]() 2NO(g)+O2(g)���ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��( )
2NO(g)+O2(g)���ܱ������з�Ӧ���ﵽƽ��״̬�ı�־��( )
�ٵ�λʱ��������n mol O2��ͬʱ����2n mol NO2
�ڵ�λʱ��������n mol O2��ͬʱ������2n mol NO
����NO2��NO��O2�����ʵ���Ũ�ȱ仯��ʾ�ķ�Ӧ���ʵı�Ϊ2:2:1��״̬
�ܻ���������ɫ���ٸı��״̬
�ݻ��������ܶȲ��ٸı��״̬
��������ƽ����Է����������ٸı��״̬
A. �٢ܢ�B. �ڢۢ�C. �٢ۢ�D. �٢ڢۢܢݢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() ʱ����
ʱ����![]() ��Ԫ����
��Ԫ����![]() ��Һ�ζ�
��Һ�ζ�![]() ��Һ���õζ�������ͼ������˵������ȷ����
��Һ���õζ�������ͼ������˵������ȷ����![]()
![]()

A.��![]() ��ʾ��Һ�У�
��ʾ��Һ�У�![]()
B.��![]() ��ʾ��Һ�У�
��ʾ��Һ�У�![]()
C.��![]() ��ʾ��Һ�У�
��ʾ��Һ�У�![]()
D.�ζ������п��ܳ��֣�![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������![]() ����Ư��֯���ά��ֽ�������ж���ά����С���ص㣮������Һ�п�����
����Ư��֯���ά��ֽ�������ж���ά����С���ص㣮������Һ�п�����![]() ��
��![]() ��
��![]() ��
��![]() �ȣ�����
�ȣ�����![]() ��
��![]() ������Ư�����ã���֪
������Ư�����ã���֪![]() �����ⶨ
�����ⶨ![]() ʱ����ֺ�����pOH�仯�����ͼ��ʾ
ʱ����ֺ�����pOH�仯�����ͼ��ʾ![]() û�л���
û�л���![]() �����¶��£����з�����ȷ����
�����¶��£����з�����ȷ����![]()
![]()

A.![]() �ĵ���ƽ�ⳣ������ֵ
�ĵ���ƽ�ⳣ������ֵ![]()
B.�������������������½��ȶ�
C.![]() ʱ����Һ�к�������Ũ�ȴ�СΪ��
ʱ����Һ�к�������Ũ�ȴ�СΪ��![]()
D.ͬŨ�ȵ�![]() ��Һ��
��Һ��![]() ��Һ�������ϣ�������Һ����
��Һ�������ϣ�������Һ����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס��ҡ�������������������ڵ����ʼ���������ͼ��ʾ����������������ݻ���ȡ��¶���ͬ����Ӧ�мס������ݻ����䣬���е�ѹǿ���䣬��һ���¶��·�Ӧ�ﵽƽ�⡣����˵����ȷ����
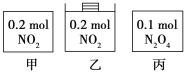
A.ƽ��ʱ��������c(NO2)�Ĵ�С˳��Ϊ��>��>��
B.ƽ��ʱN2O4�İٷֺ�������>�ף���
C.ƽ��ʱ����NO2�����N2O4��ת���ʲ�������ͬ
D.ƽ��ʱ������ƽ����Է�����������>��>��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com