
【题目】某化学兴趣小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
【实验原理】2KMnO4 + 5H2C2O4 + 3H2SO4 == K2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
【实验内容及记录】
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||
1 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
2 | 3.0 | 3.0 | 2.0 | 2.0 | 5.2 |
3 | 3.0 | 4.0 | 1.0 | 2.0 | 6.4 |
请回答:
(1)根据上表中的实验数据,可以得到的结论是 。
(2)利用实验1数据计算,用KMnO4的浓度变化表示反应速率 v(KMnO4)= 。
(3)该小组同学根据经验绘制了n(Mn2+) 随时间变化趋势的示意图,如图甲所示。但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+) 随时间变化的趋势应如图乙所示。 该小组同学根据图乙所示信息提出了新的假设,并继续进行实验探究。
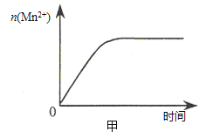
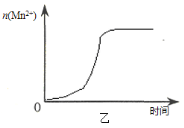
①该小组同学提出的假设是 。
②请你帮助该小组同学完成实验方案,并选表中空白处应加入的物质。
实验编号 | 室温下,试管中所加试剂及其用量 / mL | 再向试管中加入少量固体 | 室温下溶液颜色褪至无色所需时间 / min | |||
0.6 mol/L H2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
4 | 3.0 | 2.0 | 3.0 | 2.0 |
| |
A.KMnO4 B.H2C2O4 C.K2SO4 D.MnSO4
③若该小组同学提出的假设成立,应观察到的现象是 。
【答案】(1)其他条件相同时,增大KMnO4浓度(或反应物浓度),反应速率增大
(2)1.5×10-2mol·L-1·min-1或0.015 mol·L-1·min-1
(3)①生成物中的MnSO4为该反应的催化剂(或Mn2+对该反应有催化作用) ②D
③实验4与实验1比较,溶液褪色所需时间短 或:溶液褪色所用时间(t)小于4min(或其他合理答案)
【解析】
试题分析:(1)从表中数据,可知改变的条件是KMnO4浓度,其他条件相同时,增大KMnO4浓度,褪色时间变短,则反应速率增大。
(2)草酸的物质的量为:0.6mol/L×0.003L=0.0018mol,高锰酸钾的物质的量为:0.2mol/L×0.003L=0.0006mol,草酸和高锰酸钾的物质的量之比为:0.0018mol:0.0006mol=3:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:![]() =0.06mol/L,这段时间内平均反应速率v(KMnO4)=0.06mol/L÷4min=1.5×10-2 mol/(Lmin)。
=0.06mol/L,这段时间内平均反应速率v(KMnO4)=0.06mol/L÷4min=1.5×10-2 mol/(Lmin)。
(3)①由图乙可知,反应开始后速率增大的比较快,说明生成物中的MnSO4(或Mn2+)为该反应的催化剂。
②与实验1作对比实验,则加入的硫酸锰的量不同,其它条件必须相同,所以加入的少量固体为MnSO4,答案选D。
③若该小组同学提出的假设成立,则反应速率加快,溶液褪色的时间小于4min,从而说明Mn2+是催化剂。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A.沿海城市建筑时直接从海洋里取用海沙,可以大大降低成本
B.“地沟油”禁止使用,但处理后可以制生物柴油和肥皂
C.乙醇溶液、双氧水均可用于杀菌消毒,但原理不同
D.维生素C和铁粉是常用的抗氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是
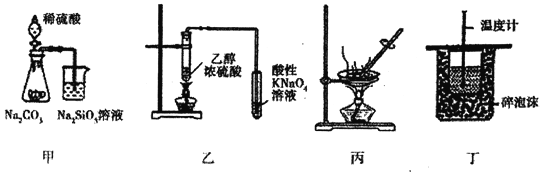
A. 图甲装罝可证明非金属性强弱:S>C>Si
B. 图乙装置可用于检验有乙烯生成
C. 图丙装置可通过蒸干AlCl3饱和溶液制备AlCl3晶体
D. 图丁装置可用来测定中和热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是( )
A. Na+、Al3+、Cl-、SO42- B. Cu2+、Cl-、NO3-、OH-,
C. Ca2+、Na+、CO32-、NO3- D. H+、SO42-、NO3-、OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
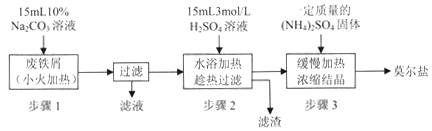
【题目】【贵州省贵阳市2017届高三2月适应性考试(一)】硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,是浅绿色晶体,可溶于水,在100℃~110℃时分解,常用作定量分析中的标准试剂。某化学小组以废铁屑为原料在实验室中进行实验探究——制备硫酸亚铁铵并检验其纯度,过程如下:
I.制备硫酸亚铁铵
请回答下列问题:
(1)步骤l的作用是_________。(用离子方程式及必要的文字说明);
(2)步骤2中所加硫酸需过量,且不宜等到铁屑完全反应后才过滤,其中蕴含的道理是_______________;
II.测定硫酸亚铁铵的纯度
称取mg实验室制备的硫酸亚铁铵样品,配成500ml溶液,取25. 00mL硫酸亚铁按溶液,用0 . 1mol/L的酸性KMnO4溶液进行滴定,再重复滴定两次。
(3)配制(NH4)2SO4·FeSO4溶液所用的蒸馏水,通常需加热煮沸一段时间后,冷却至室温再使用,这样操作的好处是___________________;
(4)滴定时发生反应的离子方程式为___________________;
(5)滴定终点时的现象为 ___________________;
(6)三次滴定测得酸性KMnO4溶液的用量平均值为VmL,则硫酸亚铁铵样品的纯度为__________;
(7)化学小组分析发现这种检测纯度的方法不够准确,目前处理氮氧化物污染的方法有多种,请你帮助他们设计一种检测方案________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列氧化剂均能氧化+4价的硫元素,为了除去稀硫酸中混有的亚硫酸,应选用的最合理的氧化剂是( )
A. KMnO4 B. Ca(ClO)2 C. Cl2 D. H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2017届山东省临沂市高三上学期期末考试】次磷酸(H3PO2)是一元中强酸,具有较强还原性,下列有关说法正确的是( )
A. 次磷酸的电离方程式为:H3PO2=H++H2PO2-
B. NaH2PO2是次磷酸的正盐,其水溶液呈中性
C. 白磷与氢氧化钠溶液反应可得次磷酸盐,反应的化学方程式为:
P4+9NaOH=3Na2PO2+PH3↑+3H2O
D. 利用(H3PO2)进行化学镀银反应中,1mol H3PO2最多还原4mol Ag+离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元弱酸(简写为H2A)溶液,按下式发生一级或二级电离:
H2A![]() H++HA—;
H++HA—;
HA—![]() H++A2—;
H++A2—;
已知同温同浓度时的电离平衡常数K(H2A)远大于K(HA—),设有下列四种溶液体系:
A. 0.01 mol/L的H2A溶液
B. 0.01 mol/L的NaHA溶液
C. 0.02 mol/L的盐酸与0.04 mol/L的NaHA溶液等体积混合液
D. 0.02 mol/L的氢氧化钠溶液与0.02 mol/L的NaHA溶液等体积混合液
据此,填写下列空白(填代号)
(1)H+浓度最大的是 ,最小的是 。
(2)H2A浓度最大的是 ,最小的是 。
(3)A2— 浓度最大的是 ,最小的是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com