
【题目】实验室用如图所示装置来制取氯气,该装置由A、B、C三个基本装置组合而成,请回答下列问题:
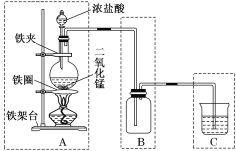
(1)说出A、B、C三个基本装置的名称:A是________装置,B是________装置,C是________装置。
(2)C装置中烧杯内所装液体是________溶液。
(3)写出A装置中反应的化学方程式_____________________________。
(4)氯气工业制法的原理为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑。
2NaOH+H2↑+Cl2↑。
此反应的氧化剂是________,________元素的化合价升高;还原剂是_________,而________元素的化合价降低。该反应中4mol氧化剂能得到(失去)________mol电子。标准状况下,反应中产生了5.6L的氢气时,被氧化的物质的质量为_________。
【答案】气体发生 气体收集(或集气) 尾气吸收 NaOH MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O H2O H NaCl Cl 4 29.25g
MnCl2+Cl2↑+2H2O H2O H NaCl Cl 4 29.25g
【解析】
(1)典型的制气装置分为四部分:气体发生装置→气体净化装置→气体收集装置→尾气吸收装置,据此进行分析。
(2)C装置是尾气吸收装置,用氢氧化钠溶液吸收多余的氯气防止污染;
(3) MnO2和浓盐酸加热反应制取氯气,据反应规律写出化学方程式;
(4) 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑反应中氯化钠做还原剂,水做氧化剂,根据氧化还原反应规律进行分析和计算。
2NaOH+H2↑+Cl2↑反应中氯化钠做还原剂,水做氧化剂,根据氧化还原反应规律进行分析和计算。
(1)典型的制气装置分为四部分:气体发生装置→气体净化装置→气体收集装置→尾气吸收装置,则由装置图可知各部分的用途,A是气体发生装置,B是气体收集或集气装置,C是尾气吸收装置;
综上所述,本题答案是:气体发生,气体收集(或集气) ,尾气吸收。
(2)C装置是尾气吸收装置,目的是吸收多余的氯气防止污染,一般用碱溶液吸收,故烧杯内所装液体可以是NaOH溶液;
综上所述,本题答案是:NaOH。
(3) MnO2和浓盐酸反应制取氯气的化学方程式为MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
综上所述,本题答案是:MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(4) 该反应中水中的氢元素由+1价降低到0价,发生还原反应,水做氧化剂;氯化钠中的氯元素化合价由-1价升高到0价,发生氧化反应,氯化钠做还原剂;根据反应可知,1molH2O参加反应,只有1molH被还原,得到1mol电子,因此该反应中4mol氧化剂(水)参加反应能得到4mol电子;5.6L的氢气的物质的量为5.6L/22.4L/mol=0.25mol;根据反应关系可知:2NaCl-- Cl2,所以被氧化的氯化钠的质量=0.25×2×58.5=29.25g;
综上所述,本题答案是:H2O,H,NaCl,Cl,4,29.25g。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】在某无色、透明的强酸性溶液中,能大量共存的离子组是( )
A.NH4+、NO3-、Al3+、Cl-B.Na+、SO42-、Ba2+、NO3-
C.MnO4-、K+、SO42-、Na+D.H+、SO42-、HCO3-、Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是一种高效的漂白剂和消毒剂,它在酸性条件下生成NaCl并放出C1O2,C1O2有类似Cl2的性质。某兴趣小组探究亚氯酸钠的制备与性质。

Ⅰ.制备亚氯酸钠
关闭止水夹②,打开止水夹①,从进气口通入足量C1O2,充分反应。
(1)仪器a的名称为_______,仪器b的作用是_____。
(2)装置A中生成NaC1O2的离子方程式为_______。
(3)若从装置A反应后的溶液中获得NaClO2晶体,则主要操作有减压蒸发浓缩、降温结晶______、_____干燥等。
Ⅱ.探究亚氯酸钠的性质
停止通ClO2气体,再通入空气一段时间后,关闭止水夹①,打开止水夹②,向A中滴入稀硫酸。
(4)开始时A中反应缓慢,稍后产生气体的速率急剧加快,请解释可能的原因_________。
(5)B中现象为_________ 。
(6)实验完成后,为防止装置中滞留的有毒气体污染空气,可以进行的操作是:再次打开止水夹①,_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.1molH2O的质量为18g/mol
B.摩尔是国际单位制中的一个基本物理量
C.3.01×1023个SO2分子的质量为32g
D.C2H5OH的摩尔质量为46g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无机化合物可根据其组成和性质进行分类。

(1)上图所示的物质分类方法名称是________。
(2)以Na、K、H、O、C、S、N中任两种或三种元素组成合适的物质,分别填在下表中。
___________、______________、_______________
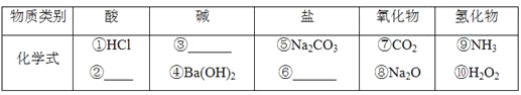
(3)写出⑦转化为⑤的化学方程式:__________________________________________。
(4)实验室制备⑦常用________和________反应,检验该气体的方法是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物D和J的合成路线如下(部分反应条件和产物己经略去):

回答下列问题:
(1)E的结构简式为_______,F的名称为_____,B中含氧官能团的名称为__________。
(2)G→I的化学方程式为_________________,丙烯→A的反应类型为______________。
(3)B的同分异构体中,分子中苯环上有5个取代基且能发生银镜反应的共有____种,其中核磁共振氢谱有5组峰,且峰面积比为1:1:2:6:6的是______(填结构简式)。
(4)结合上述流程中的信息,写出以 和CH3COOH为原料(无机试剂任选),制备化合物
和CH3COOH为原料(无机试剂任选),制备化合物 的合成路线:______________________。
的合成路线:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁红(主要成分为Fe2O3)是一种用途广泛的颜料,用废铁屑制备铁红的流程如下:

(1)操作Ⅰ的名称是_________。
(2)检验FeCO3沉淀是否洗净的实验方法是________。
(3)加入NH4HCO3溶液的反应除了生成FeCO3沉淀,还会生成一种气体,生成气体的离子方程式为________。
(4)在空气中煅烧FeCO3的化学方程式是________,若煅烧不充分,产品Fe2O3中会有FeO,为了避免产品中有FeO,可以采取的措施是________。
(5)称取3.0 g 产品,用稀硫酸溶解,逐滴加入0.10 mol·L-1 KMnO4溶液20.00 mL,二者恰好反应完全。若此产品中只含有FeO、Fe2O3,求算产品中Fe2O3的质量分数,写出计算过程___。
(已知:10FeSO4+2KMnO4+8H2SO4===5Fe2(SO4)3+2MnSO4+K2SO4+8H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com