
【题目】金属钛被称为“未来金属”,它具有硬度大,熔点高,耐腐蚀等特点。某工厂以钛铁矿(主要成分FeTiO3)为主要原料,冶炼金属Ti,其工业生产流程如图:
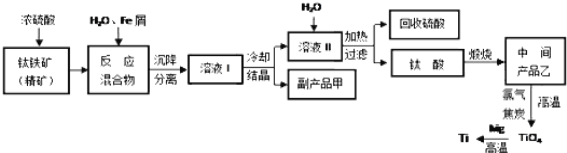
已知:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
回答下列问题:
(1)上述生产流程中加入铁屑的目的是___,检验副产品甲是否变质的实验方法是___。
(2)由溶液I获得甲晶体,需要经过___操作。除烧杯、漏斗外,过滤操作还要用到另一种玻璃仪器,该仪器在此操作中的主要作用是___。
(3)TiO2变为TiCl4的化学方程式___。但最近用熔融法直接电解中间产品乙制取金属钛获得成功,试比较用电解法生产钛比原工艺的优劣___。
(4)该工艺中消耗33.6LCl2(标况),至少可得___克甲晶体。
【答案】2Fe3++Fe=3Fe2+,将Fe3+还原为Fe2+; 取样放于试管,滴加KSCN溶液,若有血红色出现则变质,若无血红色则未变质 蒸发浓缩,冷却结晶,过滤洗涤 玻璃棒,引流作用 TiO2+2C+2Cl2![]() TiCl4+2CO 优点:工艺简便且原子利用率高,对环境无污染,缺点:耗能高 208.5g
TiCl4+2CO 优点:工艺简便且原子利用率高,对环境无污染,缺点:耗能高 208.5g
【解析】
(1) 亚铁离子易被氧化为铁离子,加入铁屑可防止Fe2+被氧化,检验副产品甲是否变质,只要检验其中是否有铁离子即可;
(2)由溶液I获得甲晶体,需要经过蒸发浓缩,冷却结晶,过滤洗涤得到晶体;
(3) TiO2变为TiCl4的反应是二氧化钛和碳、氯气反应生成;煅烧钛酸得到二氧化钛,电解熔融的二氧化钛可得到金属钛,优点:工艺简便且原子利用率高,对环境无污染,缺点:耗能高;
(4)根据FeSO47H2O ~ TiOSO4~ TiO2~2Cl2,计算晶体质量。
(1)钛铁矿和浓硫酸反应的产物是TiOSO4、FeSO4,加入铁屑可防止Fe2+被氧化,2Fe3++Fe=3Fe2+;亚铁离子易被氧化为铁离子,检验副产品甲是否变质,只要检验其中是否有铁离子即可,实验方法是:取副产品甲少许于试管中,滴加适量KSCN溶液,观察溶液是否变为血红色,如果变血红色,证明已经变质,否则没变质;
(2)由溶液I获得甲晶体,需要经过蒸发浓缩,冷却结晶,过滤洗涤得到晶体,除烧杯、漏斗外,过滤操作还要用到另一种玻璃仪器为玻璃棒,玻璃棒在此操作中的主要作用是引流作用;
(3) TiO2变为TiCl4的反应是二氧化钛和碳、氯气反应生成,反应的化学方程式为:TiO2+ 2C +2Cl2![]() TiCl4+2CO;煅烧钛酸得到二氧化钛,电解熔融的二氧化钛可得到金属钛,反应的方程式为TiO2
TiCl4+2CO;煅烧钛酸得到二氧化钛,电解熔融的二氧化钛可得到金属钛,反应的方程式为TiO2 ![]() Ti+O2↑,经对比,电解法的优点:工艺简便且原子利用率高,对环境无污染,缺点:耗能高;
Ti+O2↑,经对比,电解法的优点:工艺简便且原子利用率高,对环境无污染,缺点:耗能高;
(4)该工艺中消耗![]() 标况
标况![]() ,Cl2物质的量=
,Cl2物质的量=![]() mol=1.5mol,依据反应FeTiO3+2H2SO4 = TiOSO4+FeSO4+2H2O,TiO2+ 2C +2Cl2
mol=1.5mol,依据反应FeTiO3+2H2SO4 = TiOSO4+FeSO4+2H2O,TiO2+ 2C +2Cl2![]() TiCl4+2CO得到FeSO47H2O ~ TiOSO4~ TiO2~2Cl2,消耗
TiCl4+2CO得到FeSO47H2O ~ TiOSO4~ TiO2~2Cl2,消耗![]() Cl2,获得0.75molFeSO47H2O,则晶体质量=0.75mol ×278g/mol=208.5g。
Cl2,获得0.75molFeSO47H2O,则晶体质量=0.75mol ×278g/mol=208.5g。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】把1mol X气体和0.5mol Y气体混合于2L的密闭容器中,发生如下反应:
![]() ,2min末生成0.2mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol·L-1·min-1,试计算
,2min末生成0.2mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol·L-1·min-1,试计算
(1)前2min内,用X表示的平均反应速率____________。
(2)前2min内Y的转化率____________。
(3)化学方程式中Z的化学计量数n____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组查阅资料得知,漂白粉与硫酸溶液反应可制取氯气,化学方程式为![]() ,他们设计如下实验用于制取氯气并验证其性质。
,他们设计如下实验用于制取氯气并验证其性质。
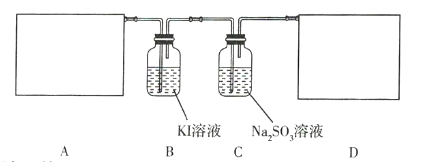
请回答下列问题。
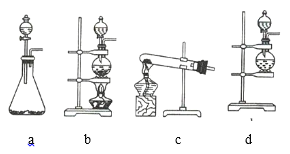
(1)该实验中A部分的装置是 _________________________________ (填序号)。
(2)B中的实验现象为 _____________________________。
(3)用离子方程式表示C中亚硫酸钠被氧化的主要原因: _____________________________。请你帮助他们设计一个实验,证明C中的亚硫酸钠已被氧化: _____________________________(简述实验步骤)。
(4)请根据题意画出D处的实验装置图,并注明装置中盛放的物质__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别将下列物质:①Al2(SO4)3②Na2CO3③KCl④CuCl2⑤FeSO4溶于水中,对其溶液加热蒸干,仍能得到原物质的是
A. ①③④⑤ B. ②④ C. ①②③ D. ①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下,几种难溶电解质的溶度积(Ksp):
化学式 | Mg(OH)2 | MgF2 | Fe(OH)3 | AgCl | Cu(OH)2 | Ag2CrO4 |
溶度积 | 5.6×10-12 | 7.4×10-11 | 4 .0×10-38 | 1.8×10-10 | 2.2×10-20 | 2.0×10-12 |
下列说法不正确的是( )
A. 在Mg(OH)2 的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
B. 在Mg(OH)2 的悬浊液中加入NaF 溶液液后,Mg(OH)2 不可能转化为MgF2
C. CuCl2溶液中混入了一定量的FeCl3溶液,可以通过向溶液中加入CuO的方法,调整溶液的pH,除去Fe3+杂质
D. 向浓度均为1×10-3mol/L 的KCl 和K2CrO4混合液中滴加1×10-3mo/LAgNO3溶液,Cl-先形成沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于化学平衡。
(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-![]() H++A2-。
H++A2-。
①NaHA溶液的pH_____Na2A溶液的pH(填大于、小于或等于)。
②某温度下,若向0.1mol/L的NaHA溶液中逐滴滴加0.1mol/L的KOH溶液至溶液呈中性。此时该混合溶液中下列关系中,一定正确的是 _____________。
A.c(H+).c(OH-)=1×10-14 B.c(Na+)+c(K+)=c(HA-)+2c(A2-) C.c(Na+)>c(K+) D.c(Na+)+c(K+)=0.05mol/L
(2)常温下,若在0.1mol/L硫酸铜溶液中加入氢氧化钠稀溶液充分搅拌,有浅蓝色氢氧化铜沉淀生成,当溶液的pH=8时,c(Cu2+)=_________ (Ksp[Cu(OH)2]=2.2×10-20)。
(3)将HI(g)置于密闭容器中,某温度下发生下列变化:2HI(g)![]() H2(g)+I2(g) △H<0
H2(g)+I2(g) △H<0
①该反应平衡常数的表达式为K=____,则H2(g)+I2(g)![]() 2HI(g)平衡常数的表达式为K1=_____(用K表示).
2HI(g)平衡常数的表达式为K1=_____(用K表示).
②当反应达到平衡时c(I2)=0.5mol/L,c(HI)=4mol/L,则c(H2)为_______,HI的分解率为______。
③能判断该反应达到平衡状态的依据是______
A.容器中压强不变 B.混合气体中c(HI)不变 C.c(I2)=c(H2) D.v(I2)正=v(H2)逆
(4)若该反应800℃达到平衡状态,且平衡常数为1.0,某时刻,测得容器内各物质的溶度分别为c(HI)=2mol/L,c(I2)=1mol/L,c(H2)=1mol/L,则该时刻,反应向______(填“正向”或“逆向”,下同)进行,若升高温度,反应向______进行。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SF6 是一种优良的绝缘气体,分子结构中只有S─F键。已知:1 mol S(s)转化为气态硫原子吸收能量280 kJ,断裂1 mol F─F 、S─F键需吸收的能量分别为160 kJ、330 kJ。则1 mol 固体硫单质参加:S(s)+3F2(g)=SF6(g)反应,完全生成SF6(g)的热效应为( )
A. 吸收430 kJ B. 释放450 kJ
C. 释放1220 kJ D. 释放1780 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】南海是一个巨大的资源宝库,开发利用海水资源是科学研究的重要课题。下图为海水资源利用的部分过程,有关说法不正确的是 ( )
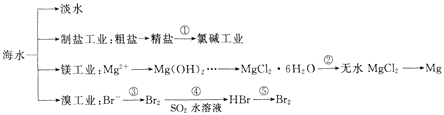
A.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法
B.氯碱工业中采用阳离子交换膜可提高产品的纯度
C.由MgCl2·6H2O得到无水MgCl2的关键是要低温小火烘干
D.溴工业中③、④的目的是富集溴元素,溴元素在反应③、⑤中均被氧化,在反应④中被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:KSP(BaSO4)=2×10-10,KSP(BaSO3)=2.5×10-7,现有一Na2SO4、Na2SO3的混合溶液,其中c(Na2SO3)=0.5mol/L,c(Na2SO4)=0.05mol/L。若向该溶液中加入等体积的0.5mol/LBaCl2溶液,充分反应后,溶液中c(Ba2+)=__(混合时溶液体积变化忽略不计)。若向该混合溶液中加BaCl2固体,当SO32-开始沉淀时,c(SO42-)=___;当SO42-沉淀完全时,c(SO32-)=___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com