
【题目】把1mol X气体和0.5mol Y气体混合于2L的密闭容器中,发生如下反应:
![]() ,2min末生成0.2mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol·L-1·min-1,试计算
,2min末生成0.2mol W,若测得以Z的物质的量浓度变化表示的平均反应速率为0.1mol·L-1·min-1,试计算
(1)前2min内,用X表示的平均反应速率____________。
(2)前2min内Y的转化率____________。
(3)化学方程式中Z的化学计量数n____________。
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:
【题目】氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为(MgCO3,舍少量FeCO3)为原料制备高纯氧化镁的实验流程如下:

(1)加入H2O2氧化时,发生反应的化学方程式为___________________________。
(2)滤渣2的成分是_________(填化学式)。
煅烧过程存在以下反应:
2MgSO4+C![]() 2MgO+2SO2↑+CO2↑;MgSO4+C
2MgO+2SO2↑+CO2↑;MgSO4+C![]() MgO+SO2↑+CO↑;MgSO4+3C
MgO+SO2↑+CO↑;MgSO4+3C![]() MgO+S↑+3CO↑。
MgO+S↑+3CO↑。
利用下图装置对煅烧产生的气体进行分步吸收或收集。

(3)D中收集的气体是__________(填化学式)。
(4)B中盛放的溶液是_________(填序号)。
a.NaOH溶液 b.Na2CO3溶液 c.稀硝酸 d..KMnO4溶液
(5)A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应在任意温度下一定能自发进行的是 ( )
A.2NaCl + 2H2O = 2NaOH + Cl2↑ +H2↑ △H > 0
B.NH3(g) + HCl(g) = NH4Cl(s) △H < 0
C.CaCO3(s) = CaO(s) + CO2(g) △H > 0
D.X2Y2(g) = X2(g) +Y2(g) △H < 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应mX(g)![]() nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
nY(g)+pZ(g) ΔH,在不同温度下的平衡体系中物质Y的体积分数随压强变化的曲线如图所示,下列说法错误的是( )
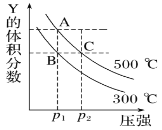
A. 该反应的ΔH>0
B. m<n+p
C. B、C两点化学平衡常数:KB>KC
D. A、C两点的反应速率v(A)<v(C)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学工业体现了化学科学的实际应用价值,下列化学工业过程,以生产盐类化合物为主要目标的是( )
A.侯氏制碱法B.煤的气化C.合成氨工业D.氯碱工业
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人们在日常生活和工农业生产中应用极为广泛的一种金属。请回答下列问题:
(1)某研究性学习小组为了证明铁的金属性比铜的强,设计了如下几种方案,其中合理的有___(填序号)。
A.铁片置于硫酸铜溶液中置换出铜
B.铁、铜与氯气反应分别生成FeCl3、CuCl2
C.铜片置于FeCl3溶液中,铜片逐渐溶解
D.铁片、铜片分别置于盛有稀硫酸的烧杯中,铁片上有气泡产生,而铜片上无气泡产生
E.常温下,将铁片和铜片分别置于浓硝酸中,铁片不溶解,而铜片溶解
(2)请你另设计一个能证明铁的金属性比铜的强的实验。要求:该实验方案的原理不同于(1)中任何一个方案。
①画出实验装置图并注明所需药品___。
②写出实验过程中的主要现象:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100多年前,“化学守护神”德国化学家李比希发现了一种至今仍在临床使用的催眠药(化合物IV)。由源自石油的基本化工原料I合成化合物IV的一种途径为:
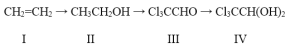
(1)由化合物I合成化合物II的反应类型为______;
(2)下列关于化合物I和化合物II的说法正确的有________(填字母)。
A. 化合物I可以作为植物生长调节剂
B. 化合物I能发生加聚反应,不能使酸性KMnO4溶液褪色
C. 化合物II能发生酯化反应
D. 化合物II不能与金属Na反应
(3)由化合物III合成化合物IV的反应的原子利用率为100%,则除化合物III外,另一种反应物是__。
(4)化合物II与IV都含有的官能团是______(填名称),化合物IV的分子式为____。
(5)为替代日益枯竭的化石资源,有人提出以富含纤维素的农林废弃物或副产物为原料获得乙醇,再制备化合物IV的方案,可用于这种用途的废弃物或副产物有____ (写两种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 开启啤酒瓶盖,瓶中立即泛起大量泡沫
B. 工业生产硫酸的过程中使用过量的空气以提高SO2的利用率
C. 将铜粉和锌粉混合后放入稀硫酸中,产生气体的速率比不加铜粉快
D. 在pH等于3的醋酸溶液中加入少量CH3COONa,溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛被称为“未来金属”,它具有硬度大,熔点高,耐腐蚀等特点。某工厂以钛铁矿(主要成分FeTiO3)为主要原料,冶炼金属Ti,其工业生产流程如图:
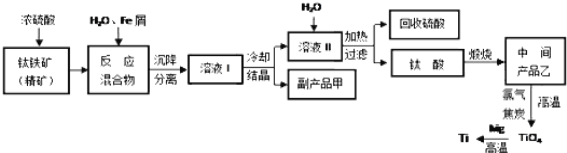
已知:FeTiO3+2H2SO4=TiOSO4+FeSO4+2H2O
回答下列问题:
(1)上述生产流程中加入铁屑的目的是___,检验副产品甲是否变质的实验方法是___。
(2)由溶液I获得甲晶体,需要经过___操作。除烧杯、漏斗外,过滤操作还要用到另一种玻璃仪器,该仪器在此操作中的主要作用是___。
(3)TiO2变为TiCl4的化学方程式___。但最近用熔融法直接电解中间产品乙制取金属钛获得成功,试比较用电解法生产钛比原工艺的优劣___。
(4)该工艺中消耗33.6LCl2(标况),至少可得___克甲晶体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com