
【题目】某化学小组采用类似制乙酸乙酯的装置(如图1),以环己醇制备环己烯
己知: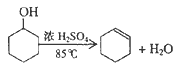
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
(1)制备粗品
将12.5mL环己醇加入试管A中,再加入lmL浓硫酸,摇匀后放入碎瓷片,慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是____________,导管B除了导气外还具有的作用是____________;
②试管C置于冰水浴中的目的是______________________。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环乙烯在______层(填上或下),分液后用___________(填入编号)洗涤。
a.KMnO4溶液 b.稀H2SO4 c.Na2CO3溶液
②再将环己烯按图2所示装置蒸馏,冷却水从________口进入,收集产品时,控制的温度应在______左右。
(3)以下区分环己烯精品和租品的方法,合理的是_____________。
a.用酸性高锰酸钾溶液 b.用NaOH溶液 c.测定沸点
【答案】防止暴沸 冷凝 进一步冷却,防止环乙烯挥发 上层 c g 83℃ c
【解析】
(1)①反应需要加热,A中碎瓷片的作用是防止暴沸,导管B比较长,能增加与空气的接触面积,其作用是导气和将生成的气体物质冷凝回流;
②试管C置于冰水浴中的目的是进一步冷却,降低环己烯蒸气的温度,使其液化,防止环己烯挥发;
(2)①环己烯不溶于水,且密度比水小,振荡、静置、分层后环己烯在上层;由于分液后环己烯粗品中还含有少量的酸和环己醇,联想制备乙酸乙酯提纯产物时用c(Na2CO3溶液)洗涤可除去酸,不能用酸性高锰酸钾,否则会氧化环己烯,所以分液后用c洗涤;
②再将环乙烯按图2所示装置蒸馏,为了使冷凝的效果更好,冷却水从冷凝管的下口即g口进入;根据题干表格提供的数据,环己烯的沸点为83℃,收集产品时,控制的温度应在环己烯的沸点83℃左右;
(3)根据混合物没有固定的沸点,而纯净物有固定的沸点,通过测定环己烯粗品和环己烯精品的沸点,也可判断产品的纯度;使用氢氧化钠没有明显的实验现象,无法区分,无论粗品还是精品中都含有环己烯,环己烯具有还原性,能够使高锰酸钾、溴水褪色,所以不能用来区别二者,合理的是c。


科目:高中化学 来源: 题型:
【题目】某研究小组用黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备ClO2气体,再用水吸收该气体可得ClO2溶液。在此过程中需要控制适宜的温度,若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2的吸收率,具体情况如图所示。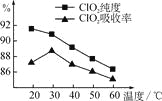
(1) 据图可知,反应时需要控制的适宜温度是________℃,要达到此要求需要采取的措施是______________。
(2) 已知:黄铁矿中的硫元素在酸性条件下可被ClO3-氧化成SO42-,请写出FeS2、氯酸钠和硫酸溶液混合反应生成二氧化氯(ClO2)的离子方程式:______________________。
(3) 该小组拟以“![]() ”作为衡量ClO2产率的指标。若取NaClO3样品6.0 g,通过反应和吸收获得400 mL ClO2溶液,取此溶液20 mL与37.00 mL 0.500 mol·L-1(NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0 mol·L-1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00 mL。反应原理为:4H++ClO2+5Fe2+=Cl-+5Fe3++2H2O;14H++Cr2O72-+6Fe2+=2Cr3++6Fe3++7H2O;
”作为衡量ClO2产率的指标。若取NaClO3样品6.0 g,通过反应和吸收获得400 mL ClO2溶液,取此溶液20 mL与37.00 mL 0.500 mol·L-1(NH4)2Fe(SO4)2溶液充分反应后,过量的Fe2+再用0.050 0 mol·L-1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00 mL。反应原理为:4H++ClO2+5Fe2+=Cl-+5Fe3++2H2O;14H++Cr2O72-+6Fe2+=2Cr3++6Fe3++7H2O;
试计算ClO2的“产率” _______________ (写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业上采用如下工艺流程,从某酸性废液(主要含Cu2+、Fe3+、H+、Cl-中制备氯化亚铜。
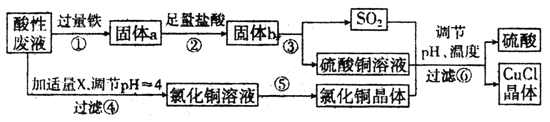
请回答下列问题:
(1)出步驟①中发生的两个主要反应的离子方程式:___。
(2)步骤②的操作名称是____。
(3)步骤④中所加物质X为_____。
(4)步骤⑤的操作是_____。
(5)步骤⑥应调节溶液pH呈酸性,且用乙醇洗涤CuCl晶体,目的是____。
(6)在CuCl的生成过程中,可以循环利用的物质是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铝合金(硬铝)中含有镁、铜、硅,为了测定该合金中铝的含量,有人设计如下实验:
(1)称取样品ag。
(2)将样品溶于足量稀盐酸中,过滤,滤液中主要含有___离子,滤渣中含有___;在溶解过滤时使用的仪器有___。
(3)往滤液中加入过量NaOH溶液,过滤,写出该步操作中有关的离子方程式____。
(4)在第(3)步的滤液中通入足量CO2过滤,将沉淀用蒸馏水洗涤数次后,烘干并灼烧至质量不再减少为止,冷却后称量,质量为bg。有关反应的化学方程式为____。
(5)计算该样品中铝的质量分数的表达式为___。
(6)若第(3)步中加入NaOH溶液的量不足时,会使测定的结果___(“偏高”“偏低”或“无影响”,下同)。若第(4)步对沉淀的灼烧不充分时,会使测定的结果___。若第(4)步中的沉淀没有用蒸馏水洗涤时,会使测定的结果____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Na2O2与水的反应,实验如图:(已知:H2O2 ![]() H+ + HO2-、HO2-
H+ + HO2-、HO2- ![]() H+ + O22-)下列分析不正确的是
H+ + O22-)下列分析不正确的是

A. ①、⑤中产生的气体能使带火星的木条复燃
B. ①、④中均发生了氧化还原反应和复分解反应
C. ②、⑤中KMnO4与MnO2的作用不同,产生气体的量也不同
D. 通过③能比较酸性:HCl>H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下转化关系,E为淡黄色粉末,通常用在呼吸面具中作为氧气的来源。

(1)A、C、E、F的化学式:
A______,C______,E______,F______。
(2)向饱和的C的溶液中通入足量CO2,会出现的现象是_____,有关反应的化学方程式为____。
(3)鉴别C与F溶液应选用的试剂是_____,有关反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钡在氧气中燃烧时得到一种钡的氧化物晶体,结构如图所示,有关说法不正确的是( )

A. 该晶体属于离子晶体
B. 晶体的化学式为Ba2O2
C. 该晶体晶胞结构与NaCl相似
D. 与每个Ba2+距离相等且最近的Ba2+共有12个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇,
(催化剂为Cu2O/ZnO):CO(g)+2H2(g)![]() CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是 ( )
CH3OH(g),甲醇的物质的量与温度的关系如下图所示,下列分析正确的是 ( )
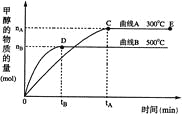
A. 反应达到平衡时,平衡常数表达式 K=c(CH3OH)/c(CO)·c2(H2)
B. 升高温度,K值增大
C. 在500℃,从反应开始到平衡,氢气的平均反应速率v(H2)=3tB/2nBmol·(L·min)-1
D. 其他条件不变,E点的体积压缩到原来的1/2,重新平衡时n(H2)/n(CH3OH)增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】5—羟色胺对人体睡眠具有调节作用,其结构简式如右图所示。下列有关5—羟色胺说法正确的是
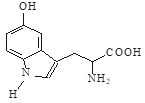
A.该有机物分子式为C11H11N2O3
B.该有机物既能和NaOH反应,也能和HCl反应
C.该有机物分子中无手性碳原子
D.1mol该物质最多可消耗溴水中2mol Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com