
����Ŀ��ij�о�С���û�����(FeS2)�������ƺ�������Һ��Ϸ�Ӧ�Ʊ�ClO2���壬����ˮ���ո�����ɵ�ClO2��Һ���ڴ˹�������Ҫ�������˵��¶ȣ����¶Ȳ���������Ӧ���ӣ�Ӱ������ClO2����Ĵ��ȣ��һ�Ӱ��ClO2�������ʣ����������ͼ��ʾ��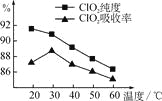
��1�� ��ͼ��֪����Ӧʱ��Ҫ���Ƶ������¶���________����Ҫ�ﵽ��Ҫ����Ҫ��ȡ�Ĵ�ʩ��______________��
��2�� ��֪���������е���Ԫ�������������¿ɱ�ClO3-������SO42-����д��FeS2�������ƺ�������Һ��Ϸ�Ӧ���ɶ�������(ClO2)�����ӷ���ʽ��______________________��
��3�� ��С��������![]() ����Ϊ����ClO2���ʵ�ָ�ꡣ��ȡNaClO3��Ʒ6.0 g��ͨ����Ӧ�����ջ��400 mL ClO2��Һ��ȡ����Һ20 mL��37.00 mL 0.500 mol��L��1(NH4)2Fe(SO4)2��Һ��ַ�Ӧ������Fe2������0.050 0 mol��L��1K2Cr2O7����Һ�ζ����յ㣬����K2Cr2O7����Һ20.00 mL����Ӧԭ��Ϊ��4H����ClO2��5Fe2��=Cl����5Fe3����2H2O��14H����Cr2O72-��6Fe2��=2Cr3����6Fe3����7H2O��
����Ϊ����ClO2���ʵ�ָ�ꡣ��ȡNaClO3��Ʒ6.0 g��ͨ����Ӧ�����ջ��400 mL ClO2��Һ��ȡ����Һ20 mL��37.00 mL 0.500 mol��L��1(NH4)2Fe(SO4)2��Һ��ַ�Ӧ������Fe2������0.050 0 mol��L��1K2Cr2O7����Һ�ζ����յ㣬����K2Cr2O7����Һ20.00 mL����Ӧԭ��Ϊ��4H����ClO2��5Fe2��=Cl����5Fe3����2H2O��14H����Cr2O72-��6Fe2��=2Cr3����6Fe3����7H2O��
�Լ���ClO2���������� _______________ (д���������)��
���𰸡�30�� ˮԡ���ȣ���ˮԡ���ƺ��£� 15ClO3-+FeS2+14H+=15ClO2+Fe3++7H2O+2SO42- ��K2Cr2O7��Ӧ��n��Fe2+��=6n��Cr2O72-��=6��20��10-3L��0.0500mol/L=6��10-3mol����ClO2��Ӧ��n��Fe2+��=37��10-3L��0.0500mol/L-6��10-3mol=1.25��10-2mol��n(ClO2)=![]() ��1.25��10-2mol=2.5��10-3mol��ClO2�IJ���=
��1.25��10-2mol=2.5��10-3mol��ClO2�IJ���=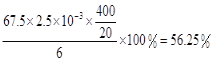
��������
��1������ͼ������¶���30��CʱClO2�����������90%���ϣ�����100��C���µ� �¶���Ҫ��ˮԡ���ȣ�
��2���û�����FeS2���������ƺ�������Һ��Ϸ�Ӧ�Ʊ�ClO2���壬����ԭ���غ㣬�����غ�͵���غ���ƽ��д���ӷ���ʽ��
��3�����ݻ�ѧ����ʽ�Ķ�����ϵ��ʽ���㣬�ԡ�![]() ����Ϊ����ClO2���ʵ�ָ�ꡣ
����Ϊ����ClO2���ʵ�ָ�ꡣ
��1����ͼ��֪����20�淴ӦʱClO2������ȡ���ȸߣ���������������ʽϵͣ���30�������Ƿ�Ӧ��ȡClO2���崿�ȸ�������������ʶ��ϸߡ����¶������ߣ���ȡClO2���崿�ȸ�������������ʶ����͡�������Ҫ���Ƶ������¶���30�棻�ﵽ��Ҫ���ȡ�����˴�ʩ��ˮԡ���ȣ���ˮԡ���ƺ��£���
(2)�������е���Ԫ�������������±�ClO3��������SO42�����Ʊ��������ȵ����ӷ���ʽΪ15ClO3����FeS2��14H��=15ClO2����Fe3����7H2O��2SO42����
��3���ɷ���ʽ4H++ClO2+5Fe2+=Cl-+5Fe3+ +2H2O��14H+ + Cr2O72-+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O�ɽ�ϵ��ӵ�ʧ�غ�ɵ�1��n(Fe2+)=5��n(ClO2)+2��3��n(Cr2O72-)����K2Cr2O7��Ӧ��n��Fe2+��=6n��Cr2O72-��=6��20��10-3L��0.0500mol/L=6��10-3mol����ClO2��Ӧ��n��Fe2+��=37��10-3L�� 0.0500mol/L -6��10-3mol=1.25��10-2mol������n(ClO2)=![]() ��1.25��10-2mol=2.5��10-3mol��ClO2�IJ���=
��1.25��10-2mol=2.5��10-3mol��ClO2�IJ���=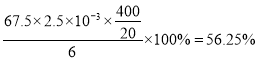 ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������ظ�����(KHSO4��2KHSO5��K2SO4)������Ư���������������Ʊ�������ͼ��
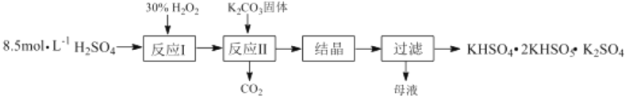
(1)��Ӧ��Ļ�ѧ����ʽΪ��H2O2+H2SO4H2SO5+H2O����H��0����Ӧ����K2CO3��H2SO5��Ӧ����KHSO5�Ļ�ѧ����ʽΪ___��
(2)����ԭ�ϵ����۱�ֵ[n(H2O2)��n(H2SO4)]Ϊ0.4��1����ʵ���������Ͷ�ϱ�Ϊ0.6��1����ԭ����___��
(3)ȷ��ȡ3.350g��������Ʒ���Ƴ�250mL��Һ��ȡ25.00mL������ƿ�У�����������ϡ�����������KI��Һ��ҡ�Ⱥ����ڰ�������ַ�Ӧ��������������Һ����0.1000mol��L-1Na2S2O3����Һ�ζ����յ㣬��������Һ20.00mL�����㸴��������Ч�ɷ�KHSO5������������(д���������)(��֪��HSO5-+I-+H+��SO42-+I2+H2O��I2+S2O32-��I-+S4O62--δ��ƽ)___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����д�ʩ����ʵ��������������ԭ�����͵���
A.���Ƶ���ˮ�ڹ�������ɫ��dz
B.H2��I2��HIƽ��������ѹ����ɫ����
C.�ںϳɰ��ķ�Ӧ�У���ѹ�����ڰ��ĺϳ�
D.Fe��SCN��3��Һ�м���NaOH����Һ��ɫ��dz
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ǻ���éȩ��һ���ջ����ϣ���Ҫ�������Ƹ̽ۡ����ϡ�ӣ�ҵȹϹ����㾫����ṹ��ʽ��ͼ��ʾ����ش��������⣺
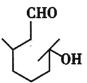
(1)�ǻ���éȩ�ķ���ʽΪ___����ϵͳ������д�������ƣ�___�����к��еĹ�������___��
(2)�۲��ǻ���éȩ�Ľṹ��ʽ�����жϸ��л������ﲻ�ܷ����ķ�Ӧ��___������ţ���
A��������Ӧ B���ӳɷ�Ӧ C����ȥ��Ӧ D��ˮ�ⷴӦ E��������Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ں��º�����ʹNH2COONH4 (s)![]() 2NH3 (g)+CO2(g)�ﵽƽ�⣬�������жϸ÷�Ӧ�ﵽ��ѧƽ����ǣ� ��
2NH3 (g)+CO2(g)�ﵽƽ�⣬�������жϸ÷�Ӧ�ﵽ��ѧƽ����ǣ� ��
A.V��(NH3) =2V��(CO2)
B.�ܱ������а����������������
C.�ܱ���������ѹǿ����
D.�ܱ������л��������ܶȲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ʯ����������Ҫ������������ϵͳ��������ҵ�ϳɸ�ҩ����м��壨F����·�����£�
�ش��������⣺
��1��D�����еĺ�������������Ϊ __________��B��C����������Ӧ����Ӧ���ͷֱ�Ϊ_______��_______��
��2��A�Ľṹ��ʽΪ________��
��3��д������ȩ��������Һ��Ӧ�Ļ�ѧ����ʽ _______��
��4��д��ͬʱ��������������B��һ��ͬ���칹��Ľṹ��ʽ��_____________��
����ʹ���CCl4��Һ��ɫ��������FeCl3��Һ������ɫ��Ӧ���۱����ϵ�һ�ȴ�����һ�֣��ܷ�������4�ֲ�ͬ��ѧ�������⡣
��5����֪૱�����![]() CH=CHCON(CH3)2 ����һ�ָ�Ч��������д����
CH=CHCON(CH3)2 ����һ�ָ�Ч��������д����![]() ��CH3CHO��NH(CH3)2Ϊԭ���Ʊ�૱����ĺϳ�·������ͼ�����Լ����ã��ϳ�·������ͼʾ����������ɣ�_________________��
��CH3CHO��NH(CH3)2Ϊԭ���Ʊ�૱����ĺϳ�·������ͼ�����Լ����ã��ϳ�·������ͼʾ����������ɣ�_________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�л���A�ĺ�����ͺ˴Ź�����������ͼ��ʾ������˵���д������
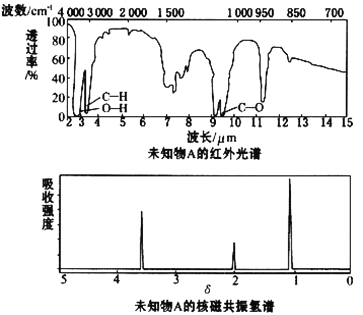
A. �ɺ������֪�����л��������ٺ������ֲ�ͬ�Ļ�ѧ��
B. �ɺ˴Ź�������֪�����л�������������ֲ�ͬ����ԭ���Ҹ�����Ϊ1��2��3
C. ������˴Ź�������֪������е���ԭ������
D. ��A�Ļ�ѧʽΪC2H6O������ṹ��ʽΪCH3CH2OH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ѧ�����յ��о��Ŷ��Ƶ�һ������ˮϵп���,�ÿɳ������п����Һ��Ϊ���Һ,��ԭ����ͼ��ʾ������˵������ȷ����
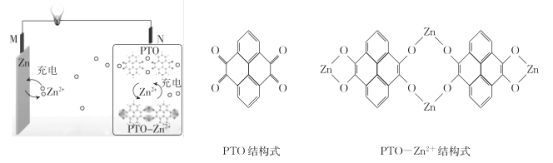
A.�ŵ�ʱ,N��������ԭ��Ӧ
B.���ʱ,Zn2+��M���ƶ�
C.�ŵ�ʱ,ÿ����1 mol PTO- Zn2+ ,M���ܽ�Zn������Ϊ260 g
D.���ʱ,N���ĵ缫��ӦʽΪ2PTO+8e- +4Zn2+=PTO- Zn2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
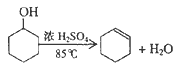
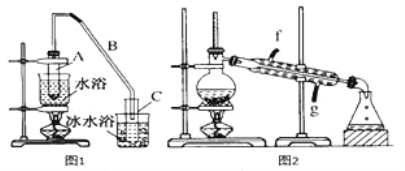
����Ŀ��ij��ѧС���������������������װ�ã���ͼ1)���Ի������Ʊ�����ϩ
��֪:
�ܶ�(g/cm3) | �۵㣨�棩 | �е㣨�棩 | �ܽ��� | |
������ | 0.96 | 25 | 161 | ������ˮ |
����ϩ | 0.81 | -103 | 83 | ������ˮ |
��1���Ʊ���Ʒ
��12.5mL�����������Թ�A�У��ټ���lmLŨ���ᣬҡ�Ⱥ�������Ƭ������������Ӧ��ȫ�����Թ�C�ڵõ�����ϩ��Ʒ��
��A�����Ƭ��������____________������B���˵�������е�������____________��
���Թ�C���ڱ�ˮԡ�е�Ŀ����______________________��
��2���Ʊ���Ʒ
�ٻ���ϩ��Ʒ�к��л������������������ʵȡ����뱥��ʳ��ˮ�������á��ֲ㣬����ϩ��______�㣨���ϻ��£�����Һ����___________(�����ţ�ϴ�ӡ�
a.KMnO4��Һ b.ϡH2SO4 c.Na2CO3��Һ
���ٽ�����ϩ��ͼ2��ʾװ��������ȴˮ��________�ڽ��룬�ռ���Ʒʱ�����Ƶ��¶�Ӧ��______���ҡ�
��3���������ֻ���ϩ��Ʒ����Ʒ�ķ�������������_____________��
a.�����Ը��������Һ b.��NaOH��Һ c.�ⶨ�е�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com