
【题目】某学生课外活动小组利用下图所示装置分别做如下实验:
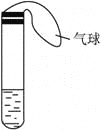
(1)在试管中注入某红色溶液,加热试管,溶液颜色逐渐变浅,冷却后恢复红色,则原溶液可能是________溶液;加热时溶液由红色逐渐变浅的原因是________________。
(2)在试管中注入某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,则此溶液可能是________溶液;加热时溶液由无色变为红色的原因是________________。
【答案】溶液NH3的酚酞 加热时NH3·H2O分解,溶液的碱性减弱,溶液的颜色逐渐变浅 溶有SO2的品红 SO2具有漂白性,SO2与品红溶液化合成不稳定的无色物质,加热时该不稳定的无色物质受热分解,SO2逸出,品红溶液又恢复红色
【解析】
(1)红色溶液加热后颜色变浅,说明该溶液加热时易分解,该溶液可能是溶有NH3的酚酞溶液 ,NH3的水溶液呈碱性,使酚酞变红,加热时NH3·H2O分解,溶液的碱性减弱,所以溶液的颜色变浅,方程式为:NH3·H2O ![]() NH3↑+ H2O;
NH3↑+ H2O;
(2)某无色溶液,加热试管,溶液变为红色,冷却后恢复无色,说明加热时产生的气体可以使红色溶液变为无色,同时生成的无色物质不稳定,很容易联想到SO2的漂白原理,所以无色溶液可能为溶有SO2的品红溶液,加热时溶液由无色变为红色的原因是:SO2具有漂白性,SO2与品红溶液化合成不稳定的无色物质,加热时该不稳定的无色物质受热分解,SO2逸出,品红溶液又恢复红色。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某温度下,在一体积恒定的密闭容器内发生反应A(s)+2B(g)![]() C(g)+D(g),当下列物理量不再变化时,能够表明反应已达平衡的是( )
C(g)+D(g),当下列物理量不再变化时,能够表明反应已达平衡的是( )
A.气体的压强B.气体的总物质的量
C.气体的平均密度D.C和D的物质的量比是定值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】复合氧化钻![]() 可用于生产合金磁性材料、催化剂等。为充分利用资源,在实验室中探究采用含钴废渣(含
可用于生产合金磁性材料、催化剂等。为充分利用资源,在实验室中探究采用含钴废渣(含![]() 等)来制备复合氧化钴,具体流程如下:
等)来制备复合氧化钴,具体流程如下:

回答下列问题:
(1)![]() 的电子式为_______________________。
的电子式为_______________________。
(2)“碱煮水洗”的目的为______________________________________________。
(3)“酸浸”时,![]() 发生反应的离子方程式为_____________________________________________;滤渣1中主要成分的化学式为_______________________。
发生反应的离子方程式为_____________________________________________;滤渣1中主要成分的化学式为_______________________。
(4)检验“水洗液”中含有![]() 的操作和现象为______________________________________________。上述流程中多次应用过滤操作该操作所用主要玻璃仪器有_____________________。
的操作和现象为______________________________________________。上述流程中多次应用过滤操作该操作所用主要玻璃仪器有_____________________。
(5)下列装置中,适合进行“焙烧”操作的是_____________________(填选项字母)。
A. B.
B. C.
C. D.
D.
(6)称量![]() ,充分“焙烧”后得复合氧化钴
,充分“焙烧”后得复合氧化钴![]() ,则复合氧化钻的化学式为________________;“焙烧”过程中生成的气体能参与大气循环,则该过程_______________(填“有”或“无”)氧气参加反应。
,则复合氧化钻的化学式为________________;“焙烧”过程中生成的气体能参与大气循环,则该过程_______________(填“有”或“无”)氧气参加反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 的捕捉和综合利用是目前研究的热点之一。回答下列问题:
的捕捉和综合利用是目前研究的热点之一。回答下列问题:
(1)科研工作者发现一种捕获二氧化碳生成甲酸的简单过程如图所示。
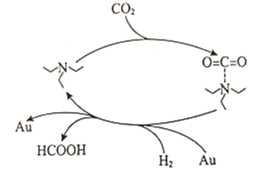
下列说法正确的是__________________(填选项字母)。
A.增大![]() 的物质的量可增大
的物质的量可增大![]() 的平衡产率
的平衡产率
B.![]() 和
和![]() 均能降低反应的活化能
均能降低反应的活化能
C.上述捕获过程能有效减少温室气体排放
(2)![]() 能用于制备二甲醚
能用于制备二甲醚
I.![]()
II.![]()
III.![]()
①二氧化碳气体与氢气生成二甲醚蒸气和水蒸气反应的热化学方程式为______________。
②![]() 时,在恒容密闭容器中发生反应I时,下列事实能说明该反应达到平衡状态的是_____________(填选项字母)。
时,在恒容密闭容器中发生反应I时,下列事实能说明该反应达到平衡状态的是_____________(填选项字母)。
A.气体的平均相对分子质量不再改变
B. ![]() 不再改变
不再改变
C.断裂![]() 键同时断裂
键同时断裂![]() 键
键
D.混合气体的密度不再改变
③![]() 时,向密闭容器中充入一定量
时,向密闭容器中充入一定量![]() ,发生反应Ⅱ,测得反应前压强为
,发生反应Ⅱ,测得反应前压强为![]() ,
,![]() 恰好达到平衡时,
恰好达到平衡时,![]() 的分压为
的分压为![]() ,则
,则![]() 内的反应速率
内的反应速率![]() _____________(用分压表示,下同);反应的平衡常数
_____________(用分压表示,下同);反应的平衡常数![]() _____________。
_____________。
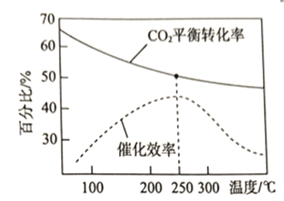
④在催化剂条件下,发生反应![]() 。
。
该反应的![]() ___________0(填“>”或“<”);
___________0(填“>”或“<”);![]() 的平衡转化率和催化剂的催化效率与温度的关系如图所示。则将反应温度选择为
的平衡转化率和催化剂的催化效率与温度的关系如图所示。则将反应温度选择为![]() 的原因为________________________________。
的原因为________________________________。
⑤向某绝热刚性容器中充入一定量的![]() 和
和![]() ,发生反应Ⅲ。容器内平衡压强______________________(填“大于”“小于”或“等于”)起始压强,原因为______________________。
,发生反应Ⅲ。容器内平衡压强______________________(填“大于”“小于”或“等于”)起始压强,原因为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、体积为2L的密闭容器中加入1molCO2和3molH2,发生如下的反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H<0。可认定该可逆反应在一定条件下已达到化学平衡状态的是
CH3OH(g)+H2O(g) △H<0。可认定该可逆反应在一定条件下已达到化学平衡状态的是
A. 容器中CO2、H2、CH3OH、H2O的物质的量之比为1∶3∶1 ∶1
B. v正(CO2)=v逆(H2O)
C. 容器内混合气体密度保持不变
D. 3molH-H键断裂同时生成3molH-O键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学仿照“喷泉”实验的原理,在实验室中做了一个“喷烟”实验,如图所示。
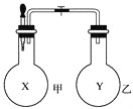
该同学在甲、乙两个烧瓶中分别充入X、Y两种无色气体,在胶头滴管中盛有含酚酞的氢氧化钠溶液,实验时将胶头滴管内的液体挤入甲烧瓶内,然后打开止水夹,便可看到甲烧瓶中的导管口喷出白色的烟,同时甲烧瓶中的溶液颜色逐渐变浅。若已知X、Y是氯化氢、氨气、氯气、氧气、甲烷、二氧化硫、一氧化氮七种气体中的两种,则下列判断中,正确的是( )
A. X是氨气,Y是氯化氢 B. X是氯气,Y是甲烷
C. X是二氧化硫,Y是氧气 D. X是一氧化氮,Y是氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2S与CO2在高温下发生反应:H2S(g)+CO2(g)![]() COS(g)+H2O(g) ΔH=-Q kJ·mol1(Q>0)。在温度为T1时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,经过4 min反应达到平衡,平衡时H2O(g)的物质的量分数为2%,则下列说法不正确的是
COS(g)+H2O(g) ΔH=-Q kJ·mol1(Q>0)。在温度为T1时,将0.10 mol CO2与0.40 mol H2S充入2.5 L的空钢瓶中,经过4 min反应达到平衡,平衡时H2O(g)的物质的量分数为2%,则下列说法不正确的是
A.CO2的平衡转化率α=2.5%
B.0~4 min内用H2S表示该反应的速率为0.001 mol·L1·min1
C.上述条件下反应达到平衡时放出的热量为0.01Q kJ
D.其他条件不变,若该反应在温度为T2条件下进行,达到平衡所需时间小于4 min,则T1<T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒温、恒容的密闭容器中存在化学平衡:H2(g)+I2(g) ![]() 2HI(g),已知H2和I2的起始浓度均为0.10molL-1,达到平衡状态时HI的浓度为0.16molL-1。若H2和I2的起始浓度均变为0.20molL-1,则平衡时H2的浓度为( )
2HI(g),已知H2和I2的起始浓度均为0.10molL-1,达到平衡状态时HI的浓度为0.16molL-1。若H2和I2的起始浓度均变为0.20molL-1,则平衡时H2的浓度为( )
A. 0.16molL-1 B. 0.08 molL-1 C. 0.04 molL-1 D. 0.02molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】P4S3是黄色或淡黄色结晶或粉末,无臭、无味、易燃、有毒,遇潮气发生分解,分子结构如图所示,已知其燃烧热ΔH=3 677 kJ/mol(P被氧化为P4O10),下列有关P4S3的说法中不正确的是
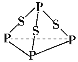
A.分子中磷元素显+3价
B.分子中每个原子最外层均达到8电子稳定结构
C.热化学方程式为P4S3(s)+8O2(g) ===P4O10(s)+3SO2(g) ΔH=3 677 kJ/mol
D.分子中存在极性键与非极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com