
【题目】我国具有悠久的历史,在春秋时期已经开始冶铁,在西汉就有湿法炼铜( )。
)。
(1)基态铁原子的电子排布式为![]() _______。
_______。
(2)铁氰化钾![]() 是检验
是检验![]() 的重要试剂,在铁氰化钾的组成元素中,属于第2周期的元素的第一电离能由小到大的顺序是_______,碳原子的杂化类型是________。
的重要试剂,在铁氰化钾的组成元素中,属于第2周期的元素的第一电离能由小到大的顺序是_______,碳原子的杂化类型是________。
(3)![]() 是一种浅黄色液体,熔点
是一种浅黄色液体,熔点![]() ,沸点103℃,易溶于苯等有机溶剂,不溶于水。
,沸点103℃,易溶于苯等有机溶剂,不溶于水。![]() 是_________分子(填“极性”或“非极性”)
是_________分子(填“极性”或“非极性”)
(4)铜常见化合价为![]() 、
、![]() 价,高温下
价,高温下![]() 比
比![]() 更稳定的原因是__________。
更稳定的原因是__________。
(5)![]() 比
比![]() 的熔点高的原因是_____________。
的熔点高的原因是_____________。
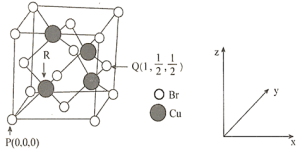
(6)一种铜的溴化物晶胞结构如图所示,由图可知,该晶体的化学式为_____________,与每个![]() 紧邻的
紧邻的![]() 有___________个,由图中的P点和Q点的原子坐标参数,可确定R点的原子坐标参数为_____。若
有___________个,由图中的P点和Q点的原子坐标参数,可确定R点的原子坐标参数为_____。若![]() 原子与最近的
原子与最近的![]() 原子的核间距为
原子的核间距为![]() ,则该晶体的密度计算表达式为
,则该晶体的密度计算表达式为![]() ______
______![]() 。
。
【答案】3d64s2 C<N sp 非极性 Cu+的价电子排布是3d10,而Cu2+的价电子排布是3d9,原子轨道处于全满、半满、全空时稳定 ![]() 和
和![]() 都是离子晶体,
都是离子晶体,![]() 的半径小于
的半径小于![]() ,所以
,所以![]() 比
比![]() 晶格能大 CuBr 12
晶格能大 CuBr 12 ![]()
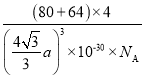
【解析】
(1)铁原子核外有26个电子,根据能量最低原理书写电子排布式;
(2)同周期元素从左到右第一电离能有增大的趋势;
(3)根据相似相溶原理分析;
(4)原子轨道处于全满、半满、全空时稳定;
(5)离子晶体,晶格能越大,熔点越高;
(6)根据晶胞图,利用均摊法计算;
(1) 铁原子核外有26个电子,基态铁原子的电子排布式为![]() 3d64s2;
3d64s2;
(2)铁氰化钾的组成元素中,属于第2周期的元素是C、N,同周期元素从左到右第一电离能有增大的趋势,第一电离能由小到大的顺序是C<N;CN-中存在![]() ,C原子的孤电子对数是
,C原子的孤电子对数是![]() ,有1个σ键,所以价电子对数是2,杂化方式是sp;
,有1个σ键,所以价电子对数是2,杂化方式是sp;
(3)苯属于非极性分子,根据相似相溶原理,![]() 易溶于苯等有机溶剂,所以
易溶于苯等有机溶剂,所以![]() 是非极性分子;
是非极性分子;
(4) Cu+的价电子排布是3d10,而Cu2+的价电子排布是3d9,原子轨道处于全满、半满、全空时稳定,所以高温下![]() 比
比![]() 更稳定;
更稳定;
(5) ![]() 和
和![]() 都是离子晶体,
都是离子晶体,![]() 的半径小于
的半径小于![]() ,所以
,所以![]() 比
比![]() 晶格能大,熔点高;
晶格能大,熔点高;
(6)根据均摊原则,1![]() ,所以该晶体的化学式为CuBr,根据晶胞图可知,与每个
,所以该晶体的化学式为CuBr,根据晶胞图可知,与每个![]() 紧邻的
紧邻的![]() 有12个,R原子位于晶胞体对角线的
有12个,R原子位于晶胞体对角线的![]() 处,由图中的P点和Q点的原子坐标参数,可确定R点的原子坐标参数为
处,由图中的P点和Q点的原子坐标参数,可确定R点的原子坐标参数为![]() 。若
。若![]() 原子与最近的
原子与最近的![]() 原子的核间距为
原子的核间距为![]() ,则体对角线为
,则体对角线为![]() ,晶胞边长为
,晶胞边长为![]() pm,则该晶体的密度计算表达式为
pm,则该晶体的密度计算表达式为![]()
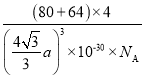
![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】 对于平衡体系:mA(g)+ nB(g)![]() pC(g)+ qD(g),下列判断正确的是( )
pC(g)+ qD(g),下列判断正确的是( )
A.若温度不变将容器的容积增大1倍,达到新平衡时A的浓度变为原来的0.45 倍,则m+n>p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m:n
C.若升高平衡体系的温度,达到新平衡时A 的浓度变为原来的0.55 倍,说明该反应△ H<0
D.若平衡后同时增大A、B的浓度,则A、B的转化率一定都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 和
和![]() 既是温室气体又是丰富的碳基资源。甲烷与二氧化碳重整反应是制合成气(
既是温室气体又是丰富的碳基资源。甲烷与二氧化碳重整反应是制合成气(![]() )的有效途径之一。合成气可用于二甲醚合成、羰基合成、费托合成等。因此,具有较好的市场前景。
)的有效途径之一。合成气可用于二甲醚合成、羰基合成、费托合成等。因此,具有较好的市场前景。
(1)已知在![]() 、298K条件下,各物质燃烧热数据如下表:
、298K条件下,各物质燃烧热数据如下表:
物质(g) |
|
|
|
|
燃烧热( | -890.0 | -283.0 | -285.0 | 0 |
则甲烷与二氧化碳重整反应制合成气的热化学方程式为:________________;
(2)在T℃时,向容积为2L的刚性容器中充入![]()
![]() 和
和![]()
![]() 。反应体系中
。反应体系中![]() 的物质的量随时间变化关系如下表:
的物质的量随时间变化关系如下表:
时间/min | 0 | 20 | 50 | 100 | |
| 0.5 | 0.48 | 0.25 | 0.25 | 0.25 |
①20min时,![]() ________
________![]() ;当反应进行到60min时,
;当反应进行到60min时,![]() ________20min时
________20min时![]() 的大小关系(填“<”、“=”或“>”);反应进行到60min时,下列能够提高平衡时合成气产率的措施有:_______________________。
的大小关系(填“<”、“=”或“>”);反应进行到60min时,下列能够提高平衡时合成气产率的措施有:_______________________。
A.将反应时间延长至150min B.移除一部分合成气
C.适当提高反应升高温度 D.改用高效催化剂
②反应进行到下列各图的p点时,能够说明该反应达到平衡状态的是:___________。
A. B.
B. C.
C.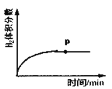 D.
D.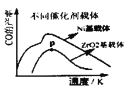
③已知:p(H2)、p(CO)、p(CH4)和p(CO2)为各组分的平衡分压(气体分压p=气体总压p总×体积分数),p总为平衡总压。若开始测得反应体系的压强为3.0Mpa,则合成气反应达到平衡状态时Kp=________。(结果保留一位小数)
(3)由于原料气的![]() 比较高,催化剂易结焦,特别是高温反应时积碳严重,影响了此过程大规模工业化的应用。某科研小组研究了Sr助剂对10%
比较高,催化剂易结焦,特别是高温反应时积碳严重,影响了此过程大规模工业化的应用。某科研小组研究了Sr助剂对10%![]() 催化剂性能的影响如表1所示,请判断催化剂上Sr助剂的最佳质量含量为________(横坐标表示Sr助剂的质量含量),判断的理由是________________(写出两点)
催化剂性能的影响如表1所示,请判断催化剂上Sr助剂的最佳质量含量为________(横坐标表示Sr助剂的质量含量),判断的理由是________________(写出两点)

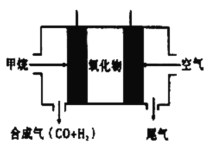
(4)如图所示,以![]() 为燃料气,高温电化学法制备合成气的发电系统中,
为燃料气,高温电化学法制备合成气的发电系统中,![]() 在电场作用下,通过氧化物电解质中氧空位迁移到负极,与
在电场作用下,通过氧化物电解质中氧空位迁移到负极,与![]() 发生氧化还原反应。试用电极反应方程式表示负极发生反应的总过程:___________________________________。
发生氧化还原反应。试用电极反应方程式表示负极发生反应的总过程:___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知浓硫酸和木炭粉在加热条件下反应:C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,根据如图回答问题:
CO2↑+2SO2↑+2H2O,根据如图回答问题:
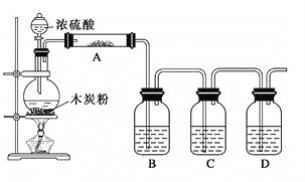
(1)上述装置中,在反应前用手掌紧贴烧瓶外壁检查装置的气密性,如观察不到明显的现象,还可以用什么简单的方法证明该装置不漏气?__。
(2)如果用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入的试剂的名称及其作用:
①A中加入的试剂是___,作用是___;
②B中加入的试剂是___,作用是___;
③C中加入的试剂是___,作用是___;
④D中加入的试剂是___,作用是___。
(3)实验时,C中应观察到的现象是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Cu与CuO的混合物20.8g加入到50mL 18.4mol/L浓H2SO4中,加热充分反应至固体物质完全溶解,冷却后将混合液稀释至1000 mL,测得c(Cu2+)=0.3 mol/L。试计算:(本题无计算过程不给分)
(1)反应过程中放出的气体在标准状况下的体积(不考虑气体在溶液中的溶解)。______
(2)溶液稀释后,c(H+)是多少?__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知稀硝酸和铜能发生反应,生成硝酸铜、一氧化氮气体和水。
(1)请写出该反应的化学方程式,并用双线桥法标出反应中电子转移的方向和数目。________
(2)一次实验中,某同学用过量的稀硝酸(其密度为1.08 g·mL-1,HNO3的质量分数为12%)跟一定量的铜片反应,产生了标准状况下0.56 L的一氧化氮。试计算(简要写出计算过程):
①该稀硝酸的物质的量浓度(结果保留小数点后一位);______________
②被还原的HNO3的物质的量。________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素及其化合物的转化关系如下图所示:

回答下列问题:
(1)实验室常用下图装置制取并收集氨气,试管中发生反应的化学方程式是_____________。
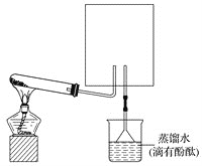
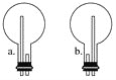
(2)上图中的方框内收集氨气的装置是________(填下图中的字母)。
(3)用NH3制取NO的化学方程式是__________________。
(4)工业上将NO2通入Na2CO3溶液中进行吸收处理,完成相应的化学方程式:2NO2+Na2CO3===NaNO2+________+________,_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把0.6molX气体和0.4molY气体混合于容积为2L的容器中,使其发生如下反应:3X(g)+Y(g)![]() nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/( L· min),则n的值为
nZ(g)+2W(g)。5min末生成0.2molW,若测知以Z浓度变化表示的平均反应速率为0.01mol/( L· min),则n的值为
A. 1B. 2C. 3D. 4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲为恒压容器、乙为恒容容器。相同条件下充入等物质的量的NO2气体,且起始时体积相同。发生反应:2NO2(g)![]() N2O4(g)△H<0。一段时间后达到平衡状态,下列说法中正确的是
N2O4(g)△H<0。一段时间后达到平衡状态,下列说法中正确的是
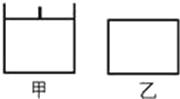
A.该反应的平衡常数表达式K=![]()
B.达到平衡所需时间,甲与乙相等
C.平衡时NO2体积分数:甲<乙
D.若两容器内气体的压强保持不变,均说明反应已达到平衡状态
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com