
【题目】以废铁屑(含有少量镍)制备高铁酸钾(K2FeO4)的流程如下图所示:
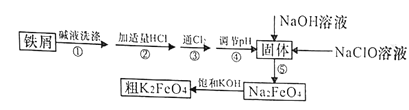
已知:25℃时,一些金属氢氧化物开始沉淀和完全沉淀时的pH如下表所示:
M(OH)m | PH | |
开始沉淀 | 沉淀完全 | |
Fe (OH)3 | 2.53 | 2.94 |
Ni(OH)2 | 7.60 | 9.75 |
(1)K2FeO4中铁元素的化合价为________________。
(2)“碱液洗涤”的目的是除去铁屑表面的油污,实际一般选用Na2CO3溶液除污,选用Na2CO3溶液除污的原理是____________________________(用离子方程式表示)。
(3)步骤③发生反应的离子方程式为___________________。
(4)步骤⑤是将Fe(OH)3固体氧化为Na2FeO4,同时NaClO转化为NaCl。则生成1mol Na2FeO4消耗NaClO的质量为______g;步骤④调节pH的范围是_______。
(5)用滴定法测定所制粗K2FeO4的纯度(杂质与KI不反应):取0.220g粗K2FeO4样品,加入足量硫酸酸化的KI溶液,充分反应后,用0.200mol·L-1Na2S2O3标准溶液滴定生成的I2,滴定消耗标准溶液的体积为20.00mL。涉及的反应有:FeO42-+4I-+8H+=Fe2++2I2+4H2O,2S2O32-+I2=S4O62-+2I-。
①滴定时选用的指示剂为______,滴定终点的现象为_____________。
②粗K2FeO4的纯度为_____________。
【答案】+6 CO32-+ H2O![]() HCO3-+ OH-,HCO3-+ H2O
HCO3-+ OH-,HCO3-+ H2O![]() H2CO3 + OH-(写出第1 步即可) 2Fe2+ + Cl2 = 2Fe3+ + 2Cl- 111.75 2. 94~7.60 淀粉 当最后一滴Na2S2O3标准溶液滴入,溶液由蓝色变为无色且半分钟内不复原 90.0%
H2CO3 + OH-(写出第1 步即可) 2Fe2+ + Cl2 = 2Fe3+ + 2Cl- 111.75 2. 94~7.60 淀粉 当最后一滴Na2S2O3标准溶液滴入,溶液由蓝色变为无色且半分钟内不复原 90.0%
【解析】
由题给流程可知,用碳酸钠溶液除去铁屑表面的油污后,加入适量盐酸溶解废铁屑,铁与盐酸反应生成氯化亚铁和氢气,再通入氯气,氯气将氯化亚铁氧化为氯化铁,调节溶液pH,使氯化铁转化为氢氧化铁沉淀,过滤;向过滤所得氢氧化铁中加入氢氧化钠溶液和次氯酸钠溶液,在碱性条件下,氢氧化铁被次氯酸钠氧化为高铁酸钠,向高铁酸钠溶液中加入饱和氢氧化钾溶液,过滤得粗高铁酸钾。
(1)由化合价代数和为零可知,高铁酸钾中铁元素为+6价,故答案为:+6;
(2)碳酸钠在溶液中水解使溶液呈碱性,可以除去铁屑表面的油污,水解的离子方程式为CO32-+ H2O ![]() HCO3-+ OH-,HCO3-+ H2O
HCO3-+ OH-,HCO3-+ H2O ![]() H2CO3 + OH-,故答案为:CO32-+ H2O
H2CO3 + OH-,故答案为:CO32-+ H2O ![]() HCO3-+ OH-,HCO3-+ H2O
HCO3-+ OH-,HCO3-+ H2O ![]() H2CO3 + OH-;
H2CO3 + OH-;
(3)步骤③发生的反应为氯气将氯化亚铁氧化为氯化铁,反应的离子方程式为2Fe2+ + Cl2 = 2Fe3+ + 2Cl-,故答案为:2Fe2+ + Cl2 = 2Fe3+ + 2Cl-;
(4)步骤⑤的反应是在碱性条件下,氢氧化铁被次氯酸钠氧化为高铁酸钠,由得失电子数目守恒可得n(NaClO)×2=n(Na2FeO4)×3,解得n(NaClO)=1.5mol,则NaClO的质量为1.5mol×74.5g/mol=111.75g;步骤④调节pH的目的是使氯化铁转化为氢氧化铁沉淀,而Ni2+不转化为沉淀,由题给数据可知,pH的范围是2. 94~7.60,故答案为:111.75;2. 94~7.60;
(5)①由题给方程式可知,滴定时是用Na2S2O3标准溶液滴定生成的I2,则应选用淀粉溶液做指示剂,滴定前溶液呈蓝色,当单质碘完全反应时,溶液蓝色褪去,且半分钟内不复原,故答案为:淀粉;当最后一滴Na2S2O3标准溶液滴入,溶液由蓝色变为无色且半分钟内不复原;
②由题给方程式可得如下关系:K2FeO4—2I2—4Na2S2O3,则n(Na2FeO4)=![]() =
=![]() =0.001mol,则粗K2FeO4的纯度为
=0.001mol,则粗K2FeO4的纯度为![]() ×100%=90.0%,故答案为:90.0%。
×100%=90.0%,故答案为:90.0%。


科目:高中化学 来源: 题型:
【题目】A、B、C、D都是短周期元素,原子半径:D>C>A>B。已知A、B同周期,A、C同主族,C原子核内的质子数等于A、B原子核内的质子数之和,C原子最外层电子数是D原子最外层电子数的3倍。请回答下列问题:
(1)A元素在周期表中的位置:____;B、D两元素形成化合物的化学式:_________。
(2)元素B、C、D的简单离子半径的大小顺序:____________(用离子符号回答)。
(3)C、D两元素最高价氧化物对应水化物的碱性强弱关系: > (用化学式表示)。________
(4)B、C形成的化合物在D元素最高价氧化物对应水化物的溶液中反应的化学方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸是重要的工业原料,可用于制造肥料、药物、炸药、颜料、洗涤剂、蓄电池等.
⑴某同学在实验室中根据2SO2(g)+O2(g)![]() 2SO3(g) ΔH =-196.6kJmol-1,设计如图所示实验装置来制备SO3固体,请完成下列问题:
2SO3(g) ΔH =-196.6kJmol-1,设计如图所示实验装置来制备SO3固体,请完成下列问题:
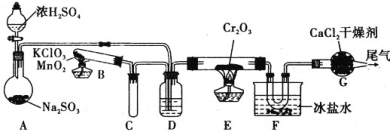
①在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸,加几滴水的作用是________。
②装置D的作用是________、________、________。
③实验开始时的操作顺序为(_______)
a.先加热E处的酒精灯后将混合气体通入E
b.先将混合气体通入E后加热E处的酒精灯
⑵浓硫酸具有强氧化性.某同学用下列装置来检验木炭能否被浓硫酸氧化成CO2
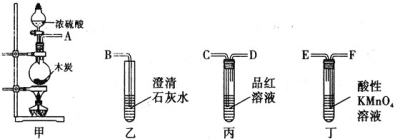
①按气流从左向右流动,连接装置的正确顺序是(用各接口字母表示) ________。
②若能被氧化成CO2,实验现象是________。
③写出装置丁中可能发生的离子反应方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究用AgNO3溶液将混合溶液中的Cl-和CrO42-沉淀分离,绘制了25℃时AgCl和Ag2CrO4两种难溶化合物的溶解平衡曲线。其中,pAg+= -lgc(Ag+),其余离子类推。两条相交的溶解平衡曲线把图像分成了X、Y、Z、M四个区域。下列说法错误的是( )
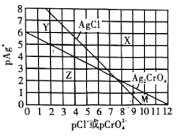
A.Ksp(Ag2CrO4)约为1 ×10-12,Ksp(AgCl)的数量级为10-10
B.M区域内可析出Ag2CrO4沉淀,而不析出AgCl沉淀
C.向Cl-、CrO42-均为0.1 mol/ L的混合溶液中逐滴加入稀硝酸银溶液,先析出AgCl沉淀
D.向Ag2CrO4、AgCl混合固体和水的溶解平衡体系中加入少量水, 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组为了探究木炭与浓硝酸反应后的气态生成物,设计如下实验。
(1)甲同学设计实验如图甲。
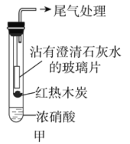
红热木炭未进入试管前,浓硝酸上方并无明显变化。当如图甲连接实验后,浓硝酸液面上方有明显的红棕色气体产生,且沾有澄清石灰水的玻璃片出现浑浊,后浑浊消失。
①液面上方出现红棕色气体,说明浓硝酸具有________(填选项字母)。
a.酸性 b.挥发性 c.不稳定性
②沾有澄清石灰水的玻璃片出现浑浊,________(填“能”或“不能”)说明木炭与浓硝酸发生了反应,是因为________。
(2)乙同学设计实验如图乙。
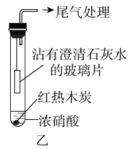
如图乙连接实验后,浓硝酸液面上方有明显的红棕色气体产生,且沾有澄清石灰水的玻璃片无明显变化。沾有澄清石灰水的玻璃片无明显变化,________(填“能”或“不能”)说明木炭与浓硝酸未反应,是因为________。
(3)丙同学克服了甲、乙同学设计上的缺点,设计实验如图丙。已知酸性高锰酸钾能将NO、NO2 氧化成 NO3-,MnO4- 被还原为 Mn2+。
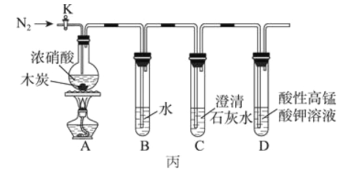
①如图连接装置后,需进行的实验操作为________;加热木炭与浓硝酸前需先通一段时间N2,目的为________________。
②装置A中木炭与浓硝酸反应的化学方程式为_________________________。
③能证明木炭被氧化的实验现象为________________________________________。
④D 装置中发生反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在TiCl3的饱溶液中通入HCl至饱和,再加入乙醚生成绿色晶体,如果不加入乙醚,直接通入HCl得到的是紫色晶体,已知两种晶体分子式均为TiCl3·6H2O,配位数都是6的配合物,分别取0.01mol两种晶体在水溶液中用过量AgNO3处理,绿色晶体得到的白色沉淀质量为紫色晶体得到沉淀质量的![]() ,则下列有关说法不正确的是( )
,则下列有关说法不正确的是( )
A.该绿色晶体配体是氯离子和水,它们物质的量之比为1:5
B.紫色晶体配合物的化学式为[Ti(H2O)6]Cl3
C.上述两种晶体的分子式相同,但结构不同,所以性质不同
D.0.01mol紫色晶体在水溶液中与过量AgNO3作用最多可得到2.78g沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t ℃时AgCl的Ksp=4×10-10 mol2·L-2,下列说法不正确的是( )
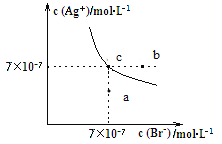
A.在t ℃时,AgBr的Ksp为4.9×10-13 mol2·L-2
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t ℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)的平衡常数K≈816
AgBr(s)+Cl-(aq)的平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.过渡金属元素性质研究在无机化学中所占的比重越来越大。
(1)铜元素在周期表的位置是______。
(2)比较NH3和[Cu(NH3)2]2+中H-N-H键角的大小:NH3______[Cu(NH3)2]2+(填“>”或“<”),并说明理由______。
(3)铜金合金是一种储氢材料,晶胞参数anm,面心立方堆积,铜原子在晶胞的面心位置,金原子在晶胞的顶点位置。已知阿伏加德罗常数的数值为NA,铜、金的摩尔质量分别为M(Cu)、M(Au),该晶体的密度为______g/cm3;氢原子可以进入到铜原子和金原子构成的四面体的空隙中,该材料储满氢后的化学式为______。
(4)研究发现,钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图1,在图中画出由钒离子形成的配合物中的配位键______。
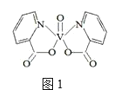
Ⅱ.氮元素可以形成多种化合物。
(5)NO3-的立体构型的名称是______,NO3-的一种等电子体为______。
(6)硫酸和硝酸都是常见的强酸,但性质差异明显:硫酸是粘稠的油状液体,沸点338℃;硝酸是无色液体,沸点仅为122℃,试从氢键的角度解释原因:______。
(7)图2表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的四个顶点(见图3),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是______(填标号)。
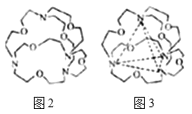
a.CF4 b.CH4 c.NH4+ d.H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)既能消毒杀菌,又能净水,是一种理想的水处理剂。工业 上制备高铁酸钾的一种工艺流程如下:
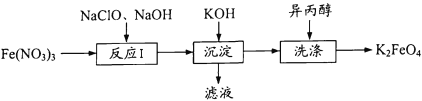
(1)K2FeO4中铁元素的化合价为 ____。
(2) “反应I”中参加反应的Fe3+与ClO-的物质的量之比为2 : 3,则滤液中含氯物质的化学式为____。写出“反应I”的离子方程式:_____。
(3)K2FeO4在水中发生反应:4K2FeO4+ 10H2O = 4Fe(OH)3 (胶体)+8KOH+3O2 ↑。高铁酸钾能消毒杀菌是因为____;它能净水是因为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com