
【题目】Ⅰ.过渡金属元素性质研究在无机化学中所占的比重越来越大。
(1)铜元素在周期表的位置是______。
(2)比较NH3和[Cu(NH3)2]2+中H-N-H键角的大小:NH3______[Cu(NH3)2]2+(填“>”或“<”),并说明理由______。
(3)铜金合金是一种储氢材料,晶胞参数anm,面心立方堆积,铜原子在晶胞的面心位置,金原子在晶胞的顶点位置。已知阿伏加德罗常数的数值为NA,铜、金的摩尔质量分别为M(Cu)、M(Au),该晶体的密度为______g/cm3;氢原子可以进入到铜原子和金原子构成的四面体的空隙中,该材料储满氢后的化学式为______。
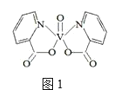
(4)研究发现,钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图1,在图中画出由钒离子形成的配合物中的配位键______。
Ⅱ.氮元素可以形成多种化合物。
(5)NO3-的立体构型的名称是______,NO3-的一种等电子体为______。
(6)硫酸和硝酸都是常见的强酸,但性质差异明显:硫酸是粘稠的油状液体,沸点338℃;硝酸是无色液体,沸点仅为122℃,试从氢键的角度解释原因:______。
(7)图2表示某种含氮有机化合物的结构,其分子内4个氮原子分别位于正四面体的四个顶点(见图3),分子内存在空腔,能嵌入某离子或分子并形成4个氢键予以识别。下列分子或离子中,能被该有机化合物识别的是______(填标号)。
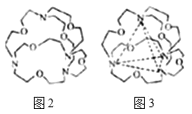
a.CF4 b.CH4 c.NH4+ d.H2O
【答案】第四周期第ⅠB族 < 因为NH3提供孤对电子与Cu2+形成配位键后,N-H成键电子对受到的排斥力减小,所以H-N-H键角增大 ![]() H8Cu3Au
H8Cu3Au  平面正三角形 CO32- 硫酸易形成分子间氢键,所以比较粘稠、沸点高;硝酸能够形成分子内氢键,所以沸点比较低 c
平面正三角形 CO32- 硫酸易形成分子间氢键,所以比较粘稠、沸点高;硝酸能够形成分子内氢键,所以沸点比较低 c
【解析】
Ⅰ.(1)铜元素在周期表的位置是第四周期第ⅠB族。故答案为:第四周期第ⅠB族;
(2)氨分子中有孤电子对,孤电子对对成键电子对作用力大,NH3和[Cu(NH3)2]2+中H-N-H键角的大小:NH3<[Cu(NH3)2]2+,理由:因为NH3提供孤对电子与Cu2+形成配位键后,N-H成键电子对受到的排斥力减小,所以H-N-H键角增大。
故答案为:< ;因为NH3提供孤对电子与Cu2+形成配位键后,N-H成键电子对受到的排斥力减小,所以H-N-H键角增大;
(3)铜金合金是一种储氢材料,晶胞参数anm,面心立方堆积,铜原子在晶胞的面心位置,金原子在晶胞的顶点位置。该晶胞中Au原子个数=8×![]() =1,Cu原子个数=6×
=1,Cu原子个数=6×![]() =3,所以该合金中Au原子与Cu原子个数之比=1:3,
=3,所以该合金中Au原子与Cu原子个数之比=1:3,
晶胞体积V=(a×10-10cm)3,每个晶胞中铜原子个数是3、Au原子个数是1,则ρ=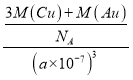 g·cm-3=
g·cm-3=![]() g·cm-3;
g·cm-3;
晶胞中Cu原子处于面心,Au原子处于顶点位置,Au原子为3个面的顶点,晶胞中Au原子与面心Cu原子构成8个四面体空隙,氢原子进入到铜原子和金原子构成的四面体的空隙中,该材料储满氢后的化学式为H8Cu3Au。
故答案为:![]() ;H8Cu3Au;
;H8Cu3Au;
(4)根据如图1,N原子最外层5个电子,其中2个电子与碳形成碳碳双键,1个电子与碳形成单键,孤电子对进入V的空轨道,形成配位键,在图中画出由钒离子形成的配合物中的配位键,如图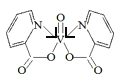 。
。
故答案为: ;
;
Ⅱ.(5)NO3-的中心原子价层电子对=3+![]() =3,sp2杂化,立体构型的名称是平面正三角形,NO3-的一种等电子体为CO32-、SO3等。
=3,sp2杂化,立体构型的名称是平面正三角形,NO3-的一种等电子体为CO32-、SO3等。
故答案为:平面正三角形 ;CO32- ;
(6)硫酸和硝酸都是常见的强酸,但性质差异明显,从氢键的角度解释原因:硫酸易形成分子间氢键,所以比较粘稠、沸点高;硝酸能够形成分子内氢键,所以沸点比较低。
故答案为:硫酸易形成分子间氢键,所以比较粘稠、沸点高;硝酸能够形成分子内氢键,所以沸点比较低;
(7)由氢键的形成条件及成键元素(N、O、F、H)可知,本题中嵌入某微粒分别与4个N原子形成4个氢键,由成键元素及数目可知为NH4+。
故答案为:c。


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:
【题目】工业上以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:
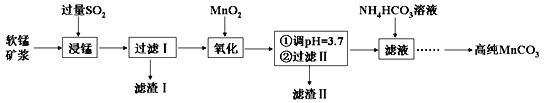
(1)过滤Ⅰ所得滤渣Ⅰ的主要成分为_________(填化学式)。
(2)“氧化”过程中除了发生MnO2与SO2的反应外,还发生另一氧化还原反应,写出该反应的离子方程式:__________________________。
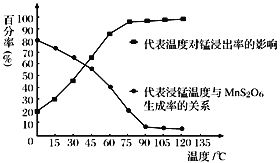
(3)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如右图所示,为减少 MnS2O6 的生成,“浸锰”的适宜温度是_______。
(4)向过滤Ⅱ所得的滤液中加入NH4HCO3 溶液时温度控制在30-35℃,温度不宜太高的原因是_______。
(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有CO2气体生成,写出反应的离子方程式:_____________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以废铁屑(含有少量镍)制备高铁酸钾(K2FeO4)的流程如下图所示:
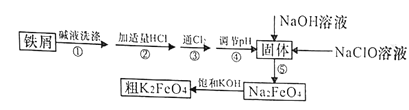
已知:25℃时,一些金属氢氧化物开始沉淀和完全沉淀时的pH如下表所示:
M(OH)m | PH | |
开始沉淀 | 沉淀完全 | |
Fe (OH)3 | 2.53 | 2.94 |
Ni(OH)2 | 7.60 | 9.75 |
(1)K2FeO4中铁元素的化合价为________________。
(2)“碱液洗涤”的目的是除去铁屑表面的油污,实际一般选用Na2CO3溶液除污,选用Na2CO3溶液除污的原理是____________________________(用离子方程式表示)。
(3)步骤③发生反应的离子方程式为___________________。
(4)步骤⑤是将Fe(OH)3固体氧化为Na2FeO4,同时NaClO转化为NaCl。则生成1mol Na2FeO4消耗NaClO的质量为______g;步骤④调节pH的范围是_______。
(5)用滴定法测定所制粗K2FeO4的纯度(杂质与KI不反应):取0.220g粗K2FeO4样品,加入足量硫酸酸化的KI溶液,充分反应后,用0.200mol·L-1Na2S2O3标准溶液滴定生成的I2,滴定消耗标准溶液的体积为20.00mL。涉及的反应有:FeO42-+4I-+8H+=Fe2++2I2+4H2O,2S2O32-+I2=S4O62-+2I-。
①滴定时选用的指示剂为______,滴定终点的现象为_____________。
②粗K2FeO4的纯度为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应中,属于氧化还原反应的是 ( )
A.Na2CO3+2HCl=2NaCl+CO2↑+H2OB.CaO+H2O=Ca(OH)2
C.2CO+O2![]() 2CO2D.CaCO3
2CO2D.CaCO3![]() CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素C与过渡元素Co、Fe、Ni等在工业、农业、科学技术以及人类生活有机合成等方面有重要作用。
(1)基态Co原子价电子轨道排布图为______,第四电离能I4(Co)<I4(Fe),其原因是______。
(2)(CH3)3C+是有机合成重要中间体,该中间体中碳原子杂化方式为______。
(3)Co2+在水溶液中以[Co(H2O)6]2+存在。向含Co2+的溶液中加入过量氨水可生成更稳定的[Co(NH3)6]2+,其原因是______。
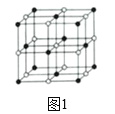
(4)Co的一种氧化物的晶胞如图1。己知钴原子的半径为apm,氧原子的半径为bpm,它们在晶体中是紧密接触的,在该钴的氧化物晶胞中原子的空间利用率为______(列出含a、b的计算表达式即可)(提示:条件不足,无法判断钴原子之间是否紧密接触)。
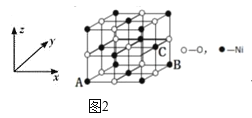
(5)NiO的晶体结构如图2所示,其中离子坐标参数A为(0,0,0),B为(1,1,0),则C离子坐标参数为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
Ⅰ.为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1g。将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。
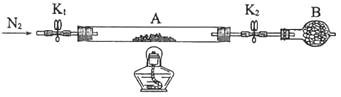
(1)仪器B的名称是______。
(2)将下列实验操作步骤正确排序______(填标号);重复上述操作步骤,直至A恒重,记为m3g。
a.点燃酒精灯,加热
b.熄灭酒精灯
c.关闭K1和K2
d.打开K1和K2,缓缓通入N2
e.称量A
f.持续通氮气,冷却至室温
(3)根据实验记录,计算绿矾化学式中结晶水数目x=______(列式表示)。
Ⅱ.已知某些硫酸盐受热易分解为相应的氧化物,为探究硫酸亚铁的分解产物,将实验Ⅰ中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红棕色粉末。
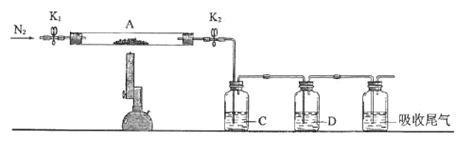
(4)C中盛放BaCl2溶液,并在实验中观察到有白色沉淀生成,其作用为:______。
(5)D中盛放的溶液为______(填标号)。
a.品红 b.NaOH c.Ba(NO3)2 e.浓H2SO4
(6)写出硫酸亚铁高温分解反应的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图中A~H均为中学化学中常见的物质,A、B、H为气体,反应①是重要的工业反应,它们之间有如下转化关系(反应中生成的水已略去)。

请回答以下问题:
(1)B是_____,D是_____,G是_____,H是_____(填化学式)。
(2)工业上常利用反应①制取漂白粉,该反应的化学方程式:__________,漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,化学反应方程式为_________。
(3)A中元素的原子结构示意图为________。
(4)F在溶液中的电离方程式为_________。
(5)上述反应中属于氧化还原反应的是_______(填写序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硫酸盐是一种常见的食品添加剂,用如下图实验可检验某食品中亚硫酸盐含量(所加试剂均足量)。下列说法不正确的是

A.亚硫酸盐作为食品添加剂,作用是防腐保鲜
B.反应①过程中通入N2的作用是将装置中空气和生成的气体全部赶出
C.测定样品质量及③中耗碱量,可测定样品中亚硫酸盐含量
D.若仅将②中的氧化剂“H2O2溶液”替换为碘水,对测定结果无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pK=-lgK,25℃时,二元酸H2A的pK1=1.85,pK2=7.19。25℃时,用0.1mol/LNaOH溶液滴定20mL0.1mol/LH2A溶液的滴定曲线如图所示。下列说法正确的是

A. a点所得溶液中:Vo=10mL
B. C点所得溶液中:c(A2-)=c(HA-)
C. b点所得溶液中:c(H2A)+c(H+)=c(HA-)+c(OH-)
D. d点所得溶液中:A2-的水解平衡常数K1=1×10-7.19
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com