
【题目】多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。

回答下列问题:
Ⅰ.硅粉与![]() 在300℃时反应生成
在300℃时反应生成![]() 气体和
气体和![]() ,放出
,放出![]() 热量,该反应的热化学方程式为________________________。
热量,该反应的热化学方程式为________________________。![]() 的电子式为__________________。
的电子式为__________________。
Ⅱ.将![]() 氢化为
氢化为![]() 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:
①![]()
![]()
②![]()
![]()
③![]()
![]()
(1)氢化过程中所需的高纯度![]() 可用惰性电极电解
可用惰性电极电解![]() 溶液制备,写出产生
溶液制备,写出产生![]() 的电极名称______(填“阳极”或“阴极”),该电极反应方程式为________________________。
的电极名称______(填“阳极”或“阴极”),该电极反应方程式为________________________。

(2)已知体系自由能变![]() ,
,![]() 时反应自发进行。三个氢化反应的
时反应自发进行。三个氢化反应的![]() 与温度的关系如图1所示,可知:反应①能自发进行的最低温度是____________;相同温度下,反应②比反应①的
与温度的关系如图1所示,可知:反应①能自发进行的最低温度是____________;相同温度下,反应②比反应①的![]() 小,主要原因是________________________。
小,主要原因是________________________。
(3)不同温度下反应②中![]() 转化率如图2所示。下列叙述正确的是______(填序号)。
转化率如图2所示。下列叙述正确的是______(填序号)。
a.B点:![]() b.
b.![]() :A点
:A点![]() 点 c.反应适宜温度:
点 c.反应适宜温度:![]() ℃
℃
(4)反应③的![]() ______(用
______(用![]() ,
,![]() 表示)。温度升高,反应③的平衡常数
表示)。温度升高,反应③的平衡常数![]() ______(填“增大”、“减小”或“不变”)。
______(填“增大”、“减小”或“不变”)。
(5)由粗硅制备多晶硅过程中循环使用的物质除![]() 、
、![]() 和
和![]() 外,还有______(填分子式)。
外,还有______(填分子式)。
【答案】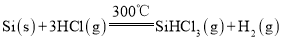
![]()
 阴极
阴极 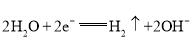 或
或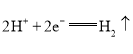 1000℃
1000℃ ![]() 导致反应②的
导致反应②的![]() 小 a、c
小 a、c ![]() 减小
减小 ![]() 、
、![]()
【解析】
I.书写热化学方程式时一定要标注出各物质的状态,要将热化学方程式中焓变的数值与化学计量数对应。本题的反应温度需要标注为条件;
II.(1)惰性电极电解KOH溶液,实质是电解水,产生氢气的必为阴极,发生还原反应。
(2)“看图说话”,将反应①的纵、横坐标对应起来看,即可顺利找到最低温度。影响自由能变的因素主要是焓变和熵变,分析发现熵变对反应②反而不利,说明焓变影响大,为主要影响因素;
(3)据图判断化学平衡的建立和移动是分析的关键。注意时间是一个不变的量。
(4)此问是盖斯定律的简单应用,对热化学方程式直接进行加减即可。
I.参加反应的物质是固态的Si、气态的HCl,生成的是气态的SiHCl3和氢气,反应条件是300℃,配平后发现SiHCl3的化学计量数恰好是1,由此可顺利写出该条件下的热化学方程式:Si(s)+3HCl(g) ![]() SiHCl3(g)+H2(g) H=-225kJ·mol-1;SiHCl3中硅与1个H、3个Cl分别形成共价单键,由此可写出其电子式为:
SiHCl3(g)+H2(g) H=-225kJ·mol-1;SiHCl3中硅与1个H、3个Cl分别形成共价单键,由此可写出其电子式为:![]() ,注意别漏标3个氯原子的孤电子对;
,注意别漏标3个氯原子的孤电子对;
II.(1)电解KOH溶液,阳极发生氧化反应而产生O2、阴极发生还原反应才产生H2;阴极的电极反应式可以直接写成2H++2e-=H2↑,或写成由水得电子也可以:2H2O+2e-=H2↑+2OH-;
(2)由题目所给的图1可以看出,反应①(最上面那条线)当G=0时,对应的横坐标温度是1000℃;从反应前后气体分子数的变化来看,反应①的熵变化不大,而反应②中熵是减小的,可见熵变对反应②的自发更不利,而结果反应②的G更负,说明显然是焓变产生了较大的影响,即H2<H1导致反应②的G小(两个反应对应的H,一个为正值,一个为负值,大小比较很明显);
(3)图2给的是不同温度下的转化率,注意依据控制变量法思想,此时所用的时间一定是相同的,所以图示中A、B、C点反应均正向进行,D点刚好达到平衡,D点到E点才涉及平衡的移动。在到达平衡状态以前,正反应速率大于逆反应速率,a项正确,B点反应正向进行,正反应速率大于逆反应速率;b点错误,温度越高,反应速率越快,所以E点的正(或逆)反应速率均大于A点;c项正确,C到D点,SiHCl3的转化率较高,选择此温度范围比较合适,在实际工业生产中还要综合考虑催化剂的活性温度。
(4)将反应①反向,并与反应②直接相加可得反应③,所以H3=H2-H1,因H2<0、H1>0,所以H3必小于0,即反应③正反应为放热反应,而放热反应的化学平衡常数随着温度的升高而减小;
(5)反应①生成的HCl可用于流程中粗硅提纯的第1步,三个可逆反应中剩余的H2也可循环使用。


科目:高中化学 来源: 题型:
【题目】关于化合物2苯基丙烯(![]() ),下列说法正确的是
),下列说法正确的是
A. 不能使稀高锰酸钾溶液褪色
B. 可以发生加成聚合反应
C. 分子中所有原子共平面
D. 易溶于水及甲苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一种叶绿素分子(左)和血红蛋白分子(右)的局部结构简图,下列说法不正确的是( )
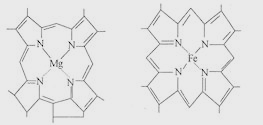
A.合成叶绿素和血红蛋白分别需要镁和铁
B.植物体缺氮会影响光合作用
C.人体缺铁会影响血红蛋白对氧的运输
D.Mg和Fe分别存在于植物和动物细胞中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式能用来解释相应实验现象的是( )
实验现象 | 离子方程式 | |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 |
|
B | 向沸水中滴加饱和氯化铁溶液得到红褐色液体 |
|
C | 二氧化硫使酸性高锰酸钾溶液褪色 |
|
D | 氧化亚铁溶于稀硝酸 |
|
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示式错误的是( )
A. Na+的轨道表示式:![]() B. Na+的结构示意图:
B. Na+的结构示意图:![]()
C. Na的电子排布式:1s22s22p63s1 D. Na的外围电子排布式:3s1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种短周期元素A,B,C,D,已知:①C,D在同一周期,A,B在同一主族;②它们可以组成化合物A2C、B2C2、DC2、D2A4等;③B的阳离子与C的阴离子的核外电子排布相同;④B2C2同A2C或DC2反应都生成气体C2,B与A2C反应生成气体A2,A2与气体C2按体积比2∶1混合后点燃发生爆炸,其产物是一种常温下常见的无色无味的液体。请回答:
(1)写出元素符号:A________、B________、C________、D________。
(2)在A2C、B2C2、DC2和D2A4中,同时含有离子键和非极性共价键的化合物的电子式为__________;按原子轨道重叠方式,其非极性键的类型是________。化合物DC2的结构式__________。
(3)A2C分子的电子式____________,按原子轨道重叠方式,其共价键的类型是____________。D2A4是平面形分子,其分子中含有______个σ键,______个π键。
(4)写出化学方程式或离子方程式:
B2C2与A2C反应的化学方程式:___________________________________________;
B2C2与DC2反应的化学方程式:___________________________________________;
B与A2C反应的离子方程式:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】抗癌药托瑞米芬的前体K的合成路线如下。

已知:
ⅰ. 
ⅱ.有机物结构可用键线式表示,如(CH3)2NCH2CH3的键线式为![]()
(1)有机物A能与Na2CO3溶液反应产生CO2,其钠盐可用于食品防腐。有机物B能与Na2CO3溶液反应,但不产生CO2;B加氢可得环己醇。A和B反应生成C的化学方程式是___________,反应类型是___________________________。
(2)D中含有的官能团:__________________。
(3)E的结构简式为__________________。
(4)F是一种天然香料,经碱性水解、酸化,得G和J。J经还原可转化为G。J的结构简式为__________________。
(5)M是J的同分异构体,符合下列条件的M的结构简式是__________________。
①包含2个六元环
②M可水解,与NaOH溶液共热时,1 mol M最多消耗2 mol NaOH
(6)推测E和G反应得到K的过程中,反应物LiAlH4和H2O的作用是__________________。
(7)由K合成托瑞米芬的过程:
![]()
托瑞米芬具有反式结构,其结构简式是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,下列各组离子在指定溶液中能大量共存的是
A. 0.1 mol·L1NaOH溶液:Na+、K+、![]() 、
、![]()
B. 0.1 mol·L1FeCl2溶液:K+、Mg2+、![]() 、
、![]()
C. 0.1 mol·L1K2CO3溶液:Na+、Ba2+、Cl、OH
D. 0.1 mol·L1H2SO4溶液:K+、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①CH3CH2CH3 ②CH3CH2CH2CH3 ③CH3CH2CH2CH2CH3 ④![]()
⑤ ⑥CH3CH2CH2CH2CH2CH3
⑥CH3CH2CH2CH2CH2CH3
上述物质的沸点按由高到低的顺序排列的是( )
A. ⑥③④⑤②① B. ⑥③②①④⑤ C. ⑤④⑥③②① D. ⑥⑤④③②①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com