
直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2,
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。
(2)在钠碱循环法中,Na2SO3溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是 。
(3)吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
n(SO32﹣):n(HSO3﹣) | 99:1 | 1:1 | 1:99 |
pH | 8.2 | 7.2 | 6.2 |
①上表判断NaHSO3溶液显 性。
②当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): 。
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+)= c(SO32-)+ c(HSO3-)+c(OH-)
(4)当吸收液的pH降至约为6时,需送至电解槽再生。再生示意图如图:
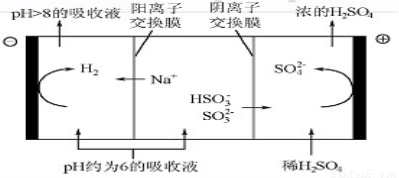
①HSO3-在阳极放电的电极反应式是 。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理: 。
(1)SO2+H2O=H2SO3 2H2SO3+O2=2H2SO4 (4分) (2)SO2+2OH-=SO32-+H2O(2分)
(3)酸 ab(4分) (4) ①HSO3—-2e-+H2O=3H++SO42- (3分)
②阴极室H+放电,OH-浓度增大,当pH>8时溶液NaOH浓度较大,可有效吸收SO2循环使用
【解析】
试题分析:(1)二氧化硫溶于水生成亚硫酸,亚硫酸具有还原性,可与被氧化为硫酸,因此用化学方程式表示SO2形成硫酸型酸雨的反应为SO2+H2O=H2SO3、2H2SO3+O2=2H2SO4。
(2)二氧化硫是酸性氧化物,因此NaOH溶液吸收SO2的离子方程式是SO2+2OH-=SO32-+H2O。
(3)当n(SO32﹣):n(HSO3﹣)=1:99时溶液显酸性,这说明HSO3﹣的电离常数大于HSO3﹣的水解程度,因此亚硫酸氢钠溶液显酸性。当n(SO32﹣):n(HSO3﹣)=1:1时溶液显碱性,因此要显中性,则亚硫酸氢钠的物质的量大于亚硫酸钠的物质的量,因此溶液中c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-),b正确;根据电荷守恒可知c(Na+)+c(H+)=2c(SO32-)+ c(HSO3-)+c(OH-),c(H+)=c(OH-),所以c(Na+)=2c(SO32-)+c(HSO3-),a正确,c不正确,答案选ab。
(4)①电解池中阳极失去电子,则HSO3-在阳极放电生成硫酸根,电极反应式是HSO3—-2e-+H2O=3H++SO42-。
②阴极是氢离子放电,则阴极室H+放电,OH-浓度增大,当pH>8时溶液NaOH浓度较大,可有效吸收SO2循环使用。
考点:考查硫酸型酸雨的形成、盐类水解和电离平衡的应用以及电解原理的应用


科目:高中化学 来源:2013-2014福建省福州八县第二学期期中考试高一化学试卷(解析版) 题型:选择题
下列各组物质的晶体中化学键类型相同,晶体类型也相同的是
A.SO2和SiO2 B.CO2和H2O C.NaCl和HCl D.NaOH和CCl4
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
室温下,对于0.10 mol·L—1的氨水,下列判断正确的是
A.与AlCl3溶液发生反应的离子方程式为Al3++3OH—=Al(OH)3↓
B.加水稀释后,溶液中c(NH4+)·c(OH—)变大
C.用HNO3溶液完全中和后,溶液不显中性
D.其溶液的pH=13
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:实验题
(14分)某课外学习小组为探究硫酸亚铁晶体(FeSO4·7H2O)制备及影响因素,进行如下实验。
Ⅰ 制取硫酸亚铁溶液
称取一定量铁屑,放入烧瓶中,加入25 mL 3 mol·L-1 硫酸,用酒精灯加热。
(1)加热一段时间后,发现烧瓶中溶液变黄并产生能使品红溶液褪色的气体。产生该现象的原因是
(用化学方程式表示)。
(2)制备过程中,铁需过量的原因是 。
Ⅱ 实验改进
该小组同学发现以上实验不完善,查阅资料后,对实验做如下
改进:①反应前通入氮气;②水浴加热,控制温度50~60℃;
③实验中适当补充硫酸调节pH=2;④增加尾气吸收装置。改进装置如图(夹持和加热装置略去)。
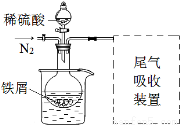
(3)实验中采用水浴加热,除了便于控制温度外,还有的优点是 。
(4)调节pH=2目的是 。
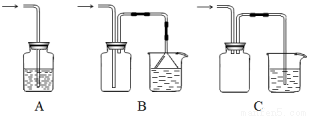
(5)下列装置适合尾气吸收的是 (填序号)。
Ⅲ 晶体纯度测定
(6)烧瓶中的溶液经处理得硫酸亚铁晶体。准确称取晶体 0.5000 g置于锥形瓶中,加入10 mL 3 mol·L-1硫酸溶液和15 mL新煮沸过的蒸馏水进行溶解,立即用0.02000 mol·L-1高锰酸钾标准溶液滴定,消耗标准溶液体积的平均值为16.90 mL。(已知:5Fe2++MnO4-+8H+=5Fe3++Mn2++4H2O)
①高锰酸钾标准溶液应盛装在 滴定管(填“酸式”或“碱式”)。
②获得硫酸亚铁晶体的纯度为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省宁德市高三5月质检理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24 L NH3分子中共价键数目为0.3 NA
B.1 L 1 mol·L-1H2O2溶液中氧原子数目为2 NA
C.25℃时,pH=7的纯水中OH-数目为1×10-7 NA
D.1 L 0.1 mol·L-1NH4Cl溶液中NH4+数目为0.1 NA
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省四地六校高三高考模拟试理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1L0.1mol·L-1的氨水中有NA个NH4+
B.常温常压下,8gO2含有4NA个电子
C.标准状况下,22.4L三氯甲烷含有NA个分子
D.1molNa被完全氧化生成Na2O2,失去2NA电子
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高三热身考试化学试卷(解析版) 题型:填空题
(15分)制烧碱所用盐水需两次精制。第一次精制主要是用沉淀法除去粗盐水中Ca2+、Mg2+、Fe3+、SO42-等离子,过程如下:
Ⅰ.向粗盐水中加入过量BaCl2溶液,过滤;
Ⅱ.向所得滤液中加入过量Na2CO3溶液,过滤;
Ⅲ.滤液用盐酸调节pH,获得一次精制盐水。
(1)过程Ⅰ、Ⅱ生成的部分沉淀及其溶解度(20℃/g)如下表:
CaSO4 | Mg2(OH)2CO3 | CaCO3 | BaSO4 | BaCO3 |
2.6×10-2 | 2.5×10-4 | 7.8×10-4 | 2.4×10-4 | 1.7×10-3 |
①检测Fe3+是否除尽的方法是________________________________________。
②过程Ⅰ选用BaCl2而不选用CaCl2,运用表中数据解释原因____________________。
③除去Mg2+的离子方程式是_______________________________。
④检测Ca2+、Mg2+、Ba2+是否除尽时,只需检测_______(填离子符号)。
(2)第二次精制要除去微量的I-、IO3-、NH4+、Ca2+、Mg2+,流程示意如下:
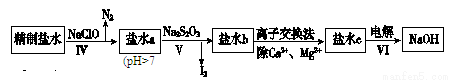
①过程Ⅳ除去的离子是________________。
②盐水b中含有SO42-。Na2S2O3将IO3-还原为I2的离子方程式是________________。
③过程VI中,在电解槽的阴极区生成NaOH,结合化学平衡原理解释:___________。
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省南平市毕业班质量检查理综化学试卷(解析版) 题型:选择题
下列选项合理的是( )
A.pH皆等于3 的两种溶液都稀释100倍后,pH都为5
B.10mL 0.02mol/L HCl溶液与10mL 0.02mol/L Ba(OH) 2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=7
C.在0.1mol/L某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
D.室温下,在一定量稀氨水中逐滴滴入稀盐酸,对于所得溶液中离子浓度大小关系
可能是:c(NH4+)>c(Cl—)>c(OH—)>c(H+)
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省高一下学期期末考试化学试卷(解析版) 题型:选择题
下列反应中,属于取代反应的是( )。
A.CH2===CH2+H2O → CH3CH2OH B.C4H10 C2H4+ C2H6
C2H4+ C2H6
C.CH3CH3+Br2 CH3CH2Br+HBr D.2C2H2+502
CH3CH2Br+HBr D.2C2H2+502 4C02+2H20
4C02+2H20
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com