
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④B.②③C.①③D.②④
科目:高中化学 来源: 题型:
【题目】50mL0.5mol/L盐酸与50mL0.55mol/LNaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热,下列说法正确的是
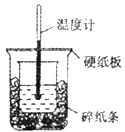
A.从实验装置上看,除了缺少环形玻璃搅拌棒外没有其他问题
B.大烧杯上如不盖硬纸板,测得的中和热数值会偏大
C.用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会偏大
D.实验中改用60mL0.5mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上实验相比,所放出的热量不相等,但是所求中和热相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在三个体积均为2 L恒容密闭容器中,反应CO(g)+2H2(g)![]() CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
CH3OH(g) ΔH<0达到平衡,得到如下数据。下列说法正确的是
容器编号 | 温度/K | 物质的起始物质的量/mol | 物质的平衡物质的量/mol | ||
CO(g) | H2(g) | CH3OH(g) | CH3OH(g) | ||
Ⅰ | T1 | 0.40 | 0.80 | 0 | 0.24 |
Ⅱ | T2 | 0 | 0 | 0.40 | 0.20 |
Ⅲ | T2 | a | b | ||
A.反应温度:T1<T2
B.达平衡时,转化率:α(CO,Ⅰ)+α(CH3OH,Ⅱ)>1
C.在容器Ⅲ中,若平衡时,CO的转化率大于H2,则![]()
D.在容器Ⅲ中,若起始时加入0.4 mol CO、0.4 mol H2和0.4 mol CH3OH,则此时v(正)>v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下存在反应:2SO2(g)+ O2(g)![]() 2SO3(g) △H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,并在400℃条件下开始反应,达到平衡时,下列说法正确的是( )
2SO3(g) △H<0。现有三个体积相同的密闭容器Ⅰ、Ⅱ、Ⅲ,并在400℃条件下开始反应,达到平衡时,下列说法正确的是( )

A.容器I、Ⅲ中平衡常数相同
B.容器II、Ⅲ中正反应速率始终相同
C.容器Ⅱ、Ⅲ中的反应达平衡时,SO3的转化率:II>III
D.容器I中SO2的转化率与容器Ⅱ中SO3的转化率之和小于1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】莲花清瘟胶囊对新冠肺炎轻症状患者有显著疗效,其有效成分绿原酸存在如图转化关系,下列有关说法正确的是( )

A.H的分子式为C17H14O4
B.Q中所有碳原子不可能都共面
C.绿原酸可发生加成、氧化和取代反应
D.W既属于羧酸类化合物又属于酚类化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中科院科学家设计出一套利用SO2和太阳能综合制氢方案,其基本工作原理如图所示,下列说法错误的是( )

A. 该电化学装置中,Pt电极作正极
B. BiVO4电极上的反应式为SO32--2e-+2OH=SO42-+H2O
C. 电子流向:Pt电极→导线→BiVO4电极→电解质溶液→Pt电极
D. Pt电极的电势高于BiVO4电极的电势
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雄黄![]() 酒,即是用研磨成粉末的雄黄泡制的白酒或黄酒,中华民族传统节日端午节的饮品。雌黄
酒,即是用研磨成粉末的雄黄泡制的白酒或黄酒,中华民族传统节日端午节的饮品。雌黄![]() 是工业制取高纯度砷的重要原料,下图是工业制纯砷流程:
是工业制取高纯度砷的重要原料,下图是工业制纯砷流程:
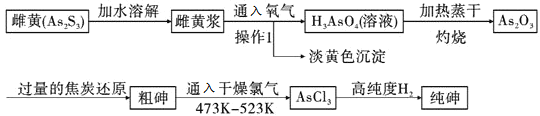
已知:砷在元素周期表中,位于硅元素相邻的右下角位置。
![]() 操作1的名称________。
操作1的名称________。
![]() 写出雌黄浆中通入氧气的化学方程式________。
写出雌黄浆中通入氧气的化学方程式________。
![]() 在粗砷的提纯过程中通常将温度控制在
在粗砷的提纯过程中通常将温度控制在![]() 以上,其目的是什么?________。
以上,其目的是什么?________。
![]() 在粗砷的提纯过程中,通入氯气这步操作为什么必须在干燥的环境中进行?________。
在粗砷的提纯过程中,通入氯气这步操作为什么必须在干燥的环境中进行?________。
![]() 写出
写出![]() 在灼烧条件下生成
在灼烧条件下生成![]() 的化学方程式:________。
的化学方程式:________。
![]() 砒霜的主要成分是
砒霜的主要成分是![]() ,古时候确定人是否砒霜中毒,常用马氏试砷法。其原理是在含砒霜的物质中加入Zn和稀硫酸,得到一种气体A,加热气体A,会得到单质砷。请写出A的化学式________。
,古时候确定人是否砒霜中毒,常用马氏试砷法。其原理是在含砒霜的物质中加入Zn和稀硫酸,得到一种气体A,加热气体A,会得到单质砷。请写出A的化学式________。
![]() 亚砷酸
亚砷酸![]() ,是三元弱酸,第一步和第二步产生
,是三元弱酸,第一步和第二步产生![]() 是通过和水中的氢氧根结合实现的,第三步则直接电离出
是通过和水中的氢氧根结合实现的,第三步则直接电离出![]() 。第一步电离方程式为:
。第一步电离方程式为:![]() ,第二步的电离方程式为________。
,第二步的电离方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列能用勒夏特列原理解释的是
A.Fe(SCN)3溶液中加入固体KSCN后颜色变深
B.工业上由氢气和氮气合成氨是在较高温度下进行的(合成氨是放热反应)
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡混和气加压后颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
SO2(g)+2CO(g)![]() 2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
2CO2(g)+S(l)△H<0 若反应在恒容的密闭容器中进行,下列有关说法正确的是
A. 平衡前,随着反应的进行,容器内压强始终不变
B. 平衡时,其他条件不变,分离出硫,正反应速率加快
C. 平衡时,其他条件不变,升高温度可提高SO2的转化率
D. 其他条件不变,使用不同催化剂,该反应平衡常数不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com