
 如图所示,①、②、③、④分别是几种常用漏斗的上部,A、B、C、D是实际应用操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图(图中漏斗及容器中的药品和其他物品均已略去,铁架台、铁夹也已略去).请根据实际使用操作时上述漏斗的范围和它们的形状,下列哪一种匹配是不合适的( )
如图所示,①、②、③、④分别是几种常用漏斗的上部,A、B、C、D是实际应用操作(分液、制气、向容器中加液体试剂等)时,各种漏斗的下部插入容器中的示意图(图中漏斗及容器中的药品和其他物品均已略去,铁架台、铁夹也已略去).请根据实际使用操作时上述漏斗的范围和它们的形状,下列哪一种匹配是不合适的( )| A、制备二氧化碳:A与③ | B、过滤:B与④ | C、用双氧水和二氧化锰制氧气:C与① | D、添加酒精:D与③ |


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
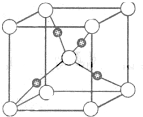
查看答案和解析>>
科目:高中化学 来源: 题型:
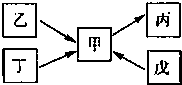 甲、乙、丙、丁、戊均为中学化学常见的单质或化合物,且均含有同一种元素R,在一定条件下其转化关系如图所示.
甲、乙、丙、丁、戊均为中学化学常见的单质或化合物,且均含有同一种元素R,在一定条件下其转化关系如图所示.| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
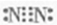
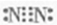
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 元素 | 有关信息 |
| X | 元素主要化合价为-2,原子半径为0.074nm |
| Y | 所在主族序数与所在周期序数之差为4 |
| Z | 原子半径为0.102nm,其单质在X的单质中燃烧,发出明亮的蓝紫色火焰 |
| D | 最高价氧化物对应的水化物,能电离出电子数相等的阴、阳离子 |
| E | 单质是生活中常见金属,其制品在潮湿空气中易被腐蚀或损坏 |
| ||
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com