
【题目】I.甘肃马家密遗址出土的青铜刀是我国最早治炼的青铜器,由于时间久远,其表面有一层“绿锈”,“绿锈”俗称“铜録”,是铜和空气中的水蒸气、CO2、O2作用产生的,化学式为[Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐、CO2和H2O。某同学利用以下反应实现了“铜→铜绿→……→铜”的转化。
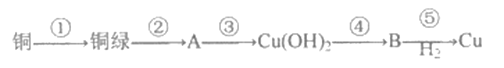
(1)从物质分类标准看,“铜绿”属于______(填字母)。
A.酸 B.碱 C.盐 D.氧化物
(2)写出B的化学式:____________。
(3)请写出铜録与盐酸反应的化学方程式:________________________。
(4)上述转化过程中属于化合反应的是_______________(填序号)
II.胶体是一种常见的分散系,回答下列问题。用Fe(OH)3胶体进行下列实验:
(5)将其装入U型管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色_______,这说明_________,这种现象称为____________________________。
(6)向其中滴入过量稀硫酸,现象是___________,其原因是______________________。
【答案】CCuOCu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑①加深胶体粒子带(正)电荷电泳先出现红褐色沉淀后沉淀溶解开始加入稀硫酸时,胶体发生聚沉生成氢氧化铁沉淀,当酸过量时,又将氢氧化铁溶解
【解析】
I.能电离出金属阳离子和酸根阴离子的化合物是盐;铜和空气中的水蒸气、CO2、O2作用产生Cu2(OH)2CO3,Cu2(OH)2CO3与盐酸反应生成氯化铜、二氧化碳、水;氯化铜与氢氧化钠反应生成氢氧化铜沉淀,氢氧化铜加热分解为氧化铜,氧化铜用氢气还原为铜单质。II. Fe(OH)3胶粒带正电荷,在通电条件下发生电泳,加入电解质溶液发生聚沉现象。
(1)能电离出金属阳离子和酸根阴离子的化合物是盐,从物质分类标准看,“铜绿”[Cu2(OH)2CO3]属于盐,选C;(2)氢氧化铜加热分解为氧化铜,所以B的化学式是CuO;(3)Cu2(OH)2CO3与盐酸反应生成氯化铜、二氧化碳、水,反应的化学方程式是Cu2(OH)2CO3+4HCl=2CuCl2+3H2O+CO2↑;(4)多种物质生成一种物质的反应是化合反应,所以铜和空气中的水蒸气、CO2、O2作用产生Cu2(OH)2CO3,属于化合反应,选①;(5)Fe(OH)3胶粒带正电荷,将其装入U型管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色加深,这说明Fe(OH)3胶体粒子带正电荷,这种现象称为电泳;(6)向Fe(OH)3胶体中滴入过量稀硫酸,开始加入稀硫酸时,胶体发生聚沉生成氢氧化铁沉淀,当酸过量时,又将氢氧化铁溶解,所以现象是先出现红褐色沉淀后沉淀溶解。


科目:高中化学 来源: 题型:
【题目】实验室配制450 mL 0.5 mol·L-1的NaCl溶液,有如下操作步骤:
①把称量的NaCl晶体放入小烧杯中,加适量蒸馏水溶解。
②把①所得溶液小心转入所选容量瓶中。
③继续向容量瓶中加蒸馏水至液面距刻度1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为______________(填序号)。
(2)本实验用到的仪器有托盘天平、药匙、玻璃棒、烧杯、__________________。
(3)某同学观察液面的情况如图所示,对所配溶液浓度将有何影响?__________(填“偏高”“偏低”或“无影响”)。

(4)若出现如下情况,对所配溶液浓度将有何影响?加蒸馏水时不慎超过了刻度__________。(填“偏高”“偏低”或“无影响”)
(5)若使用5 mol·L-1的NaCl溶液稀释来配制450 mL 0.5 mol·L-1的NaCl溶液,则需要5 mol·L-1的NaCl溶液________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,0.1mol·L-1的HNO2、HCOOH、HCN、H2CO3的溶液,它们的电离平衡常数分别为4.6×10-4、1.8×10-4、4.9×10-10、K1=4.3×10-7和K2=5.6×10-11,其中氢离子浓度最小的是
A. HNO2 B. HCOOH
C. HCN D. H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种由KCl、NaCl组成的混合物中,钾、钠离子的物质的量之比是1:2,则此混合物中,KCl的质量分数是___________.如果该混合物中含6molCl-,那么,此混合物中有NaCl__________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在同体积0.3 mol·L-1的H2SO4、HCl、CH3COOH溶液中,加入足量的Zn粉,下列说法中错误的是
A. 硫酸中放出氢气量最多 B. 醋酸中放出氢气速率最慢
C. 盐酸中放出的氢气量最多 D. 盐酸和醋酸中放出的氢气相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“低碳生活”是生态文明的前提和基础,减少二氧化碳的排放是“低碳”的一个重要方面,因此,二氧化碳的减排已引起国际社会的广泛关注。请回答下面二氧化碳回收利用的有关问题:
I.利用太阳能等可再生能源,通过光催化、光电催化或电解水制氢来进行二氧化碳加氢制甲醇时发生的主要反应是:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
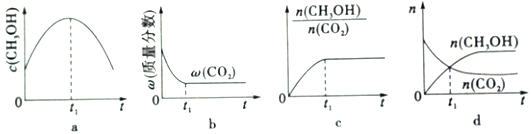
(1)若二氧化碳加氢制甲醇反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明该反应进行到1,时刻达到平衡状态的是____________(填字母编号)
(2)常压下,二氧化碳加氢制甲醇反应时的能量变化如图1所示,则该反应的△H=_____。
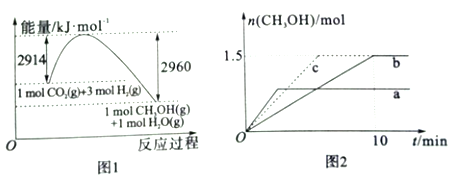
(3)在2L恒容密闭容器a和b中分别投入2molCO2和6molH2在不同温度下进行二氧化碳加氢制甲醇反应,各容器中甲醇的物质的量与时间关系如图2所示:
①若实验a、实验b的反应温度分别为T1、T2,则判断T1_____T2 (选填”>”、“<”或“=”)。若实验b中改变条件时,反应情况会由曲线b变为曲线c,则改变的条件是________。
②计算实验b条件下,0--10min段氢气的平均反应速率v(H2)=_____mol/(L·min)。
③在实验b条件下,该反应的平衡常数为_________。若平衡时向容器再充入1molCO2和3molH2,重新达平衡时,混合气体中甲醇的物质的量分数______30%(选填“>”“<”或“=”)。
II.右图是通过人工光合作用,以CO2和H2O为原料制备HCOOH和O2的原理示意图。
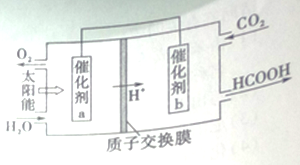
(4)催化剂a表面发生的电极反应式_________。
(5)标准状况下每回收44.8LCO2转移的的电子数为_______个。
(6)常温下,0.1mol/L的HCOONa溶液的pH为10,则常温下,HCOOH的电离常数Ka约为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1.28g某气体氧化物(化学式为RO2)在标准状况下的体积为448mL。
(1)该氧化物的摩尔质量为________。
(2)R的相对原子质量为____________。
(3)与3.6g水含有相同数目氧原子的该气体在标准状况下的体积为_______。
(4)同温同压下,同体积的甲烷(CH4)和二氧化碳物质的量之比为________。原子总数之比为_________,密度之比为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为1 mol/L KCl、CuCl2、AlCl3三种溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3︰2︰1时,所用KCl、CuCl2、AlCl3三种溶液的体积比为( )
A. 9︰6︰2 B. 9︰3︰1 C. 6︰3︰2 D. 6︰3︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钨有“光明使者”的美誉,在自然界中主要以钨(+6价)酸盐的形式存在,黑钨矿的主要成分是铁和锰的钨酸盐,化学式常写成(Fe、Mn)WO4,钨酸(B)酸性很弱,难溶于水,黑钨矿传统冶炼工艺的第一阶段是碱熔法,第二阶段则是用还原剂还原出金属钨。化合物A、B、C含有同一元素。请回答下列问题:

(1)为提高水浸速率,采取的措施为___________________(写两种)。
(2)用还原剂还原出金属钨。
①碳和氢气均可还原化合物C得钨,用氢气比用碳更具有优点,其理由是___________。
②如果用金属铝与化合物C反应,还原出1mol钨至少需要铝的质量为___________。
(3)利用“化学蒸气转移法”提纯金属钨的反应原理为:W(s)+I2(g)![]() WI2(g) △H<0。
WI2(g) △H<0。
①一定温度下,向某恒容密闭容器中加入2molI2(g)和足量W(s)达平衡后,I2(g)的转化率为20%,则平衡时c[I2(g)]∶c[WI2(g)]=___________;相同条件下,若开始加入I2(g)的物质的量变为原来2倍,则下列数值是原来2倍的有___________(填标号)。
A.平衡常数 B.达到平衡的时间
C.I2(g)的物质的量浓度 D.平衡时WI2(g)的体积分数
②工业上利用上述反应原理提纯金属钨的示意图如右:

反应在真空石英管中进行,先在温度为T1端放入不纯W粉末和少量I2(g),一段时间后,在温度为T2的一端得到纯净的晶体,则温度T1___________T2(填:“>”、“<”或“=”)。
(4)写出黑钨矿中FeWO4在步骤Ⅰ中反应的化学方程式__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com