
【题目】在25℃时,0.1mol·L-1的HNO2、HCOOH、HCN、H2CO3的溶液,它们的电离平衡常数分别为4.6×10-4、1.8×10-4、4.9×10-10、K1=4.3×10-7和K2=5.6×10-11,其中氢离子浓度最小的是
A. HNO2 B. HCOOH
C. HCN D. H2CO3
科目:高中化学 来源: 题型:
【题目】硫钠电池是一种以金属钠为负极、硫为正极、陶瓷管为电解质隔膜(作用是传递Na+)的二次电池,其原理可以表示为2Na+xS![]() Na2Sx 。现将该电池用于电化学法合成氨,电源两极分别连接两铂电极。下列有关说法错误的是
Na2Sx 。现将该电池用于电化学法合成氨,电源两极分别连接两铂电极。下列有关说法错误的是
A. 硫钠电池放电时负极反应为:Na-e-=Na+
B. 硫钠电池充电时,每生成1molNa转移xmol电子
C. 铂电极b为电解池阴极,电极反应式为N2+6e-+6H+=2NH3
D. 合成氨过程中H+经质子交换膜由a极向b极迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硅及硅的化合物的叙述中,正确的是( )
A. 硅是光导纤维的主要成分 B. 硅是构成岩石与许多矿物的基本元素
C. SiO2是酸性氧化物,不与任何酸发生反应 D. 可以通过SiO2一步制得硅酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】基础知识填空:
(1)氢氧化铁胶体制备的化学方程式_______________,所得分散系及下列物质分别用激光照射,与该分散系现象相同的是______。
A、淀粉溶液 B、澄清水 C、纳米铁 D、豆浆
(2)装置的选择:
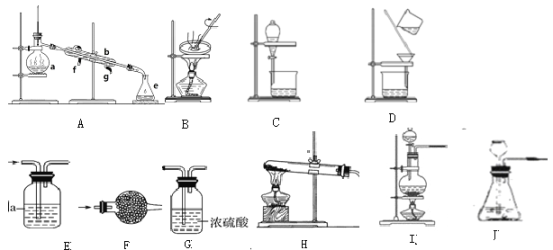
a、干燥氨气______。
b、分离植物油和水______。
c、检验CO中的是否含有CO2______。
d、分离碘和四氯化碳______。
e、实验室用氢氧化钙和氯化铵共热制氨气______。
f、实验室用稀盐酸和石制二氧化碳______。
(3)以物质的量为中心的计算
①、12.4gNa2X中含Na+0.4mol,则X的相对原子质量是______。
②、500mL质量分数为49%的硫酸溶液,密度为1.392g/cm3,则溶液的物质的量浓度为______________mol/L,其中含有SO42-的数目约为______(保留三位有效数字)。
(4)一定物质的量浓度溶液的配制:
①、实验室要配制480mL0.25mol·L-1的FeSO4溶液,需称量绿矾(FeSO4·7H2O)______g,
②、由于错误操作,使得实际浓度比所要求的偏小的是______(填写编号)。
A 称量绿矾时,左码右物
B 使用容量瓶配制溶液时,俯视液面定容,所得溶液的浓度
C 没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
D 容量瓶刚用蒸馏水洗净,没有干燥
E 定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
F 把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
③、定容时,若加蒸馏水时不慎超过刻度线,处理方法是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图为海水吸收CO2并进行碳循环的原理示意图。下列说法错误的是

A. “光合”作用中太阳能转化为化学能
B. 钙化中释放CO2的反应为:2 NaHCO3+CaCl2==CaCO3↓+CO2↑+2NaCl+H2O
C. 吸收的CO2与钙化中释放的CO2的量相等
D. 此碳循环中将CO2转化为无机物和有机物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaSO4·2H2O受热会逐步失去结晶水。取纯净的CaSO4·2H2O固体3.44 g进行加热,测定固体质量随温度的变化情况如右图所示。C点固体的化学式是________________。T3~T4温度段加热固体所产生的气体是形成酸雨的主要物质之一,则D~E段发生反应的化学方程式为____________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为保护环境,应减少二氧化硫、氮氧化物和二氧化碳等物质的排放量。
(1)用CH4催化还原煤燃烧产生的氮氧化物,可以消除污染。
已知:CH4(g) + 2NO2(g)=N2(g) +CO2(g) + 2H2O(g) △H=-867.0 kJ/mol
NO2(g)=![]() N2O4(g) △H=-28.5 kJ/mol
N2O4(g) △H=-28.5 kJ/mol
写出CH4催化还原N2O4(g)生成CO2、N2和H2O(g)的热化学方程式 。
(2)一定条件下,将NO2与SO2以体积比1∶2置于恒温恒容的密闭容器中,发生NO2(g)+SO2(g)![]() SO3(g)+NO(g),测得反应达到平衡时NO2与SO2体积比为1∶5,则平衡常数K= (填数值)。
SO3(g)+NO(g),测得反应达到平衡时NO2与SO2体积比为1∶5,则平衡常数K= (填数值)。
(3)如图1是一种用NH3、O2脱除烟气中NO的原理,该原理中NO最终转化为H2O和 (填化学式),当消耗1mol NH3和0.5molO2时,除去的NO在标准状况下的体积为 L。

(4)研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。有人利用图2所示装置(均为惰性电极)从海水中提取CO2(海水中无机碳95 % 以HCO3-存在),有利于减少环境中温室气体含量。
①a室的电极反应式为 。
②b室中提取CO2的反应的离子方程式为 。
③b室排出的海水(pH<6)不可直接排回大海,需用该装置中产生的物质对b室排出的海水进行处理,合格后才能排回大海。处理的方法是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.甘肃马家密遗址出土的青铜刀是我国最早治炼的青铜器,由于时间久远,其表面有一层“绿锈”,“绿锈”俗称“铜録”,是铜和空气中的水蒸气、CO2、O2作用产生的,化学式为[Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐、CO2和H2O。某同学利用以下反应实现了“铜→铜绿→……→铜”的转化。
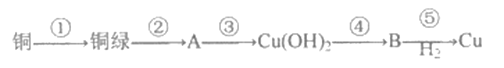
(1)从物质分类标准看,“铜绿”属于______(填字母)。
A.酸 B.碱 C.盐 D.氧化物
(2)写出B的化学式:____________。
(3)请写出铜録与盐酸反应的化学方程式:________________________。
(4)上述转化过程中属于化合反应的是_______________(填序号)
II.胶体是一种常见的分散系,回答下列问题。用Fe(OH)3胶体进行下列实验:
(5)将其装入U型管中,用石墨电极接通直流电,通电一段时间后,发现阴极附近的颜色_______,这说明_________,这种现象称为____________________________。
(6)向其中滴入过量稀硫酸,现象是___________,其原因是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食品安全已成为近几年来社会关注的热点问题之一。下列有关食品添加剂使用的说法正确的是( )
A. 为了调节食品色泽,改善食品外观,使用工业色素苏丹红
B. 为了提高奶粉中的氮含量,加入适量的三聚氰胺
C. 为了防止食品腐败,加入适量苯甲酸钠以达到阻抑细菌繁殖的作用
D. 食盐是咸味剂,无防腐作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com