
【题目】基础知识填空:
(1)氢氧化铁胶体制备的化学方程式_______________,所得分散系及下列物质分别用激光照射,与该分散系现象相同的是______。
A、淀粉溶液 B、澄清水 C、纳米铁 D、豆浆
(2)装置的选择:
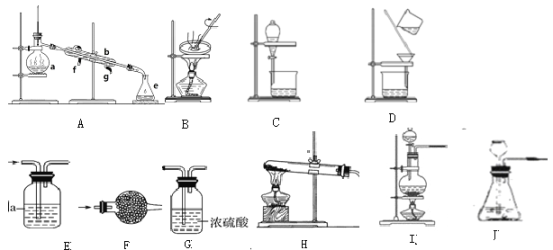
a、干燥氨气______。
b、分离植物油和水______。
c、检验CO中的是否含有CO2______。
d、分离碘和四氯化碳______。
e、实验室用氢氧化钙和氯化铵共热制氨气______。
f、实验室用稀盐酸和石制二氧化碳______。
(3)以物质的量为中心的计算
①、12.4gNa2X中含Na+0.4mol,则X的相对原子质量是______。
②、500mL质量分数为49%的硫酸溶液,密度为1.392g/cm3,则溶液的物质的量浓度为______________mol/L,其中含有SO42-的数目约为______(保留三位有效数字)。
(4)一定物质的量浓度溶液的配制:
①、实验室要配制480mL0.25mol·L-1的FeSO4溶液,需称量绿矾(FeSO4·7H2O)______g,
②、由于错误操作,使得实际浓度比所要求的偏小的是______(填写编号)。
A 称量绿矾时,左码右物
B 使用容量瓶配制溶液时,俯视液面定容,所得溶液的浓度
C 没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中
D 容量瓶刚用蒸馏水洗净,没有干燥
E 定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切
F 把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用
③、定容时,若加蒸馏水时不慎超过刻度线,处理方法是______。
【答案】FeCl3 + 3H2O == Fe(OH)3(胶体) + 3HClADFCEAHJ166.962.09×1024个34.8ACEF重新配制
【解析】
(1)把饱和氯化铁溶液滴入沸水中,继续加热,得到红褐色液体为氢氧化铁胶体,化学方程式:FeCl3 +3H2O == Fe(OH)3(胶体) +3HCl;胶体具有丁达尔效应,淀粉溶液、豆浆均为胶体,此两种分散系分别用激光照射,与氢氧化铁胶体分散系现象相同;而澄清水为溶液,纳米铁不属于胶体,没有丁达尔现象;综上所述,本题答案是:FeCl3 + 3H2O ==Fe(OH)3(胶体)+3HCl ;AD。
(2)a、干燥氨气用碱石灰,固体干燥剂放在球形干燥管内,选F装置;因此本题答案是:F。
b、植物油和水互不相溶,液体分层,可用分液进行分离,选C装置;因此本题答案是:C。
c、CO2能够与石灰水反应,而一氧化碳不与石灰水反应,选E装置;因此本题答案是:E。
d、碘和四氯化碳互溶,不分层,但是二者沸点不同,可以采用蒸馏进行分离,选A 装置;因此本题答案是:A。
e、实验室用氢氧化钙和氯化铵共热制氨气,为固体和固体加热反应制备气体,应用H装置;因此本题答案是:H。
f、实验室用稀盐酸和石制二氧化碳,固体和液体反应制备气体,不需要加热,应用J装置;因此本题答案是:J。
(3)①X的原子量为R,Na2X的物质的量为12.4/ (23×2+R)mol,含有Na+0.4mol,因此2×12.4/(23×2+R)=0.4,R=16;则X的相对原子质量是16;因此本题答案:16。
②、根据公式:c=1000×ρ×ω/M,溶液的物质的量浓度=1000×1.392×49%/98=6.96mol/L,500mL该溶液中含有SO42-的量为:0.5×6.96=3.48mol, 含有SO42-数目约为3.48×6.02×1023=2.09×1024个;综上所述,本题答案是:6.96,2.09×1024个。
(4)①、实验室要配制480mL溶液,只能选用500mL容量瓶,因此需要绿矾的质量为0.25×0.5×278=34.8 g;因此本题答案是:34.8。
②A 称量绿矾时,左码右物,称量物质量等于砝码质量-游码质量,称的绿矾质量偏小,实际浓度比所要求的偏小,可选;
B 使用容量瓶配制溶液时,俯视液面定容,造成溶液体积偏小,所得溶液的浓度偏高,不选;
C 没有用蒸馏水洗烧杯2~3次,并将洗液移入容量瓶中,造成溶质的量偏小,所得溶液的浓度偏低,可选;
D 容量瓶刚用蒸馏水洗净,没有干燥,不影响溶质的量和溶液的体积,所得溶液的浓度不变,不选;
E 定容时,滴加蒸馏水,先使液面略高于刻度线,再吸出少量水使液面凹面与刻度线相切,造成溶质的量减小,所得溶液的浓度偏低,可选;
F 把配好的溶液倒入刚用蒸馏水洗净的试剂瓶中备用,相当于给溶液进行稀释,浓度偏小,可选;
综上所述,符合题意的选项有ACEF;本题答案是: ACEF。
③、定容时,若加蒸馏水时不慎超过刻度线,溶液体积无法确定,处理方法倒掉溶液,重新配制;综上所述,本题答案是:重新配制。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】实验室配制450 mL 0.5 mol·L-1的NaCl溶液,有如下操作步骤:
①把称量的NaCl晶体放入小烧杯中,加适量蒸馏水溶解。
②把①所得溶液小心转入所选容量瓶中。
③继续向容量瓶中加蒸馏水至液面距刻度1~2 cm处,改用胶头滴管小心滴加蒸馏水至溶液凹液面底部与刻度线相切。
④用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶,并轻轻摇匀。
⑤将容量瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为______________(填序号)。
(2)本实验用到的仪器有托盘天平、药匙、玻璃棒、烧杯、__________________。
(3)某同学观察液面的情况如图所示,对所配溶液浓度将有何影响?__________(填“偏高”“偏低”或“无影响”)。

(4)若出现如下情况,对所配溶液浓度将有何影响?加蒸馏水时不慎超过了刻度__________。(填“偏高”“偏低”或“无影响”)
(5)若使用5 mol·L-1的NaCl溶液稀释来配制450 mL 0.5 mol·L-1的NaCl溶液,则需要5 mol·L-1的NaCl溶液________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家在1965年9月首先用人工方法合成牛胰岛素。为了证实人工合成的胰岛素与天然的是否是同一物质,在人工合成牛胰岛素过程中掺入了放射性14C,然后将人工合成的牛胰岛素与天然的混合得到了放射性14C分布均匀的结晶物,从而证明了两者都是同一种物质,为我国在国际上首先合成具有生物活性牛胰岛素提供了有力证据。在人工合成过程中掺入放射性14C的用途是 ( )
A. 催化剂 B. 媒介质 C. 组成元素 D. 示踪原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下CH3COOH和NH3·H2O的电离平衡常数分别为Ka、Kb。若在常温下向0.1mol/L的醋酸溶液中逐滴加入相同浓度的氨水直至完全过量,则下列说法正确的是
A. 加入氨水的过程中,溶液的导电性一直不断增强
B. CH3COONH4在水溶液中的水解平衡常数Kh=Kw/(Ka+Kb)
C. 若Ka≈Kb,当加入等体积的氨水时,溶液基本呈中性
D. 该等式在滴加过程中始终成立c(CH3COO-)+c(CH3COOH)=c(NH4+)+c(NH3·H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的产物中,存在同分异构体的是( )
A. CH3CH2CH2Br在碱性溶液中水解
B. 甲苯在催化剂(FeBr3)作用下与Br2发生苯环上的取代反应
C. ![]() 与NaOH的醇溶液共热反应
与NaOH的醇溶液共热反应
D. ![]() 在催化剂存在下与H2完全加成
在催化剂存在下与H2完全加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,0.1mol·L-1的HNO2、HCOOH、HCN、H2CO3的溶液,它们的电离平衡常数分别为4.6×10-4、1.8×10-4、4.9×10-10、K1=4.3×10-7和K2=5.6×10-11,其中氢离子浓度最小的是
A. HNO2 B. HCOOH
C. HCN D. H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某种由KCl、NaCl组成的混合物中,钾、钠离子的物质的量之比是1:2,则此混合物中,KCl的质量分数是___________.如果该混合物中含6molCl-,那么,此混合物中有NaCl__________g.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为1 mol/L KCl、CuCl2、AlCl3三种溶液,分别与AgNO3溶液反应,当生成的AgCl沉淀的质量之比为3︰2︰1时,所用KCl、CuCl2、AlCl3三种溶液的体积比为( )
A. 9︰6︰2 B. 9︰3︰1 C. 6︰3︰2 D. 6︰3︰1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com