
”¾ĢāÄæ”æŅŅ¶žĖį(HOOC-COOH)Ė×³Ę²ŻĖį”£²ŻĖį¾§ĢåµÄ»ÆѧŹ½ĪŖH2C2O4”¤2H2O£¬²ŻĖįŌŚ100”ꏱæŖŹ¼Éż»Ŗ£¬157”ꏱ“óĮæÉż»Ŗ£¬²¢æŖŹ¼·Ö½ā²śÉśCO”¢CO2ŗĶH2O£¬²ŻĖįÕōĘųŌŚµĶĪĀĻĀæÉĄäÄżĪŖ¹ĢĢ壻²ŻĖįŹĒŅ»ÖÖ¶žŌŖČõĖįµ«ĖįŠŌ±ČĢ¼ĖįĒ棬¾ßÓŠ»¹ŌŠŌÄÜŹ¹ĖįŠŌøßĆĢĖį¼ŲČÜŅŗĶŹÉ«£¬²ŻĖįøĘÄŃČÜÓŚĖ®£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©Š“³ö²ŻĖį¾§ĢåŹÜČČ·Ö½āµÄ»Æѧ·½³ĢŹ½___”£
£Ø2£©æÉÓĆĻĀĮŠ×°ĮDŃéÖ¤²ŻĖį¾§ĢåµÄ·Ö½ā²śĪļ(²ŻĖį¾§Ģå·Ö½ā×°ÖĆ”¢¼Š“ż×°ÖĆ¼°Į¬½Óµ¼¹Ü¾łĀŌČ„)”£
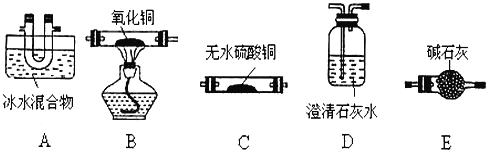
¢Ł×°ÖƵÄĮ¬½ÓĖ³ŠņĪŖ£ŗ___”¢___DEDE___”¢___”£
¢ŚA×°ÖƵÄ×÷ÓĆŹĒ___£¬¼ģŃé²śĪļÖŠÓŠCOµÄŹµŃéĻÖĻóŹĒ___”£
¢ŪŠ“³öÕūĢ××°ÖĆ“ęŌŚ²»ŗĻĄķÖ®“¦___”£
£Ø3£©ĻĀĮŠŠšŹöÄÜĖµĆ÷²ŻĖį¾ßÓŠČõĖįŠŌµÄŹĒ___”£
a.½«²ŻĖį¾§ĢåČÜÓŚŗ¬·ÓĢŖµÄNaOHČÜŅŗÖŠ£¬ČÜŅŗĶŹÉ«
b.²ā¶Ø²ŻĖįÄĘ(Na2C2O4)ČÜŅŗµÄpH
c.µČĢå»żµČÅØ¶ČµÄ²ŻĖįČÜŅŗŗĶĻ”ĮņĖį£¬Ļ”ĮņĖįĻūŗļīµÄÄÜĮ¦Ēæ
d.pH=2µÄ²ŻĖįČÜŅŗŗĶĻ”ĮņĖį£¬·Ö±šĻ”ŹĶ100±¶ŗóĒ°ÕßpHŠ”
e.½«²ŻĖį¾§Ģå¼ÓČėNa2CO3ČÜŅŗÖŠ£¬ÓŠCO2·Å³ö
£Ø4£©ŅŃÖŖ£ŗNH3”¤H2ONH4++OH-£¬Kb=1.85”Į10-5
H2C2O4H++HC2O4-£¬Ka1=5.4”Į10-2
HC2O4-H++C2O42-£¬Ka2=5.4”Į10-5
Ōņ(NH4)2C2O4ČÜŅŗµÄpH___7(Ģī”°>”±»ņ”°<”±»ņ”°=”±)”£
£Ø5£©æÉÓĆ0.10mol/LĖįŠŌKMnO4±ź×¼ČÜŅŗĄ“µĪ¶ØĪ“ÖŖÅØ¶ČµÄ²ŻĖįČÜŅŗ”£
¢ŁČ·¶Ø¹ż³ĢÖŠ·¢Éś·“³ÉµÄĄė×Ó·½³ĢŹ½ĪŖ___£»
¢ŚµĪ¶Ø¹ż³ĢÖŠ²Ł×÷µĪ¶Ø¹ÜµÄĶ¼Ź¾ÕżČ·µÄŹĒ___”£
¢ŪĆæ“Ī×¼Č·ĮæČ”25.00mL²ŻĖįČÜŅŗ£¬µĪ¶ØČż“Ī·Ö±šĻūŗÄ0.10mol/LĖįŠŌKMnO4±ź×¼ČÜŅŗµÄĢå»żŹĒ20.00mL”¢19.80mL”¢20.20mL£¬ŌņøĆ²ŻĖįČÜŅŗµÄĪļÖŹµÄĮæÅضČĪŖ___”£
”¾“š°ø”æH2C2O4”¤2H2O![]() CO”ü+CO2”ü+3H2O A C B D ³żČ„»ģŗĻĘųĢåÖŠµÄ²ŻĖįÕōĘų BÖŠµÄ¹ĢĢåÓÉŗŚÉ«±äĪŖ×ĻŗģÉ«£¬BŗóD×°ÖĆÖŠµÄ³ĪĒåŹÆ»ŅĖ®±ä»ė×Ē ĪŽCOµÄĪ²Ęų“¦Ąķ×°ÖĆ bd < 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2”ü+8H2O A 0.20mol/L
CO”ü+CO2”ü+3H2O A C B D ³żČ„»ģŗĻĘųĢåÖŠµÄ²ŻĖįÕōĘų BÖŠµÄ¹ĢĢåÓÉŗŚÉ«±äĪŖ×ĻŗģÉ«£¬BŗóD×°ÖĆÖŠµÄ³ĪĒåŹÆ»ŅĖ®±ä»ė×Ē ĪŽCOµÄĪ²Ęų“¦Ąķ×°ÖĆ bd < 2MnO4-+5H2C2O4+6H+=2Mn2++10CO2”ü+8H2O A 0.20mol/L
”¾½āĪö”æ
£Ø1£©²ŻĖį·Ö½ā²śÉśCO”¢![]() ŗĶ
ŗĶ![]() £¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ
£¬·“Ó¦·½³ĢŹ½ĪŖ£ŗ
H2C2O4”¤2H2O![]() CO”ü+CO2”ü+3H2O£¬ ¹Ź“š°øĪŖ£ŗH2C2O4”¤2H2O
CO”ü+CO2”ü+3H2O£¬ ¹Ź“š°øĪŖ£ŗH2C2O4”¤2H2O![]() CO”ü+CO2”ü+3H2O£»
CO”ü+CO2”ü+3H2O£»
£Ø2£©¢Ł·Ö½ā²śĪļĪŖCO”¢![]() ŗĶ
ŗĶ![]() £¬¼ģŃ鏱ӦøĆĻČÓĆĪŽĖ®ĮņĖįĶ¼ģŃéĖ®ÕōĘų£¬Č»ŗóÓĆ³ĪĒåŹÆ»ŅĖ®¼ģŃ鶞Ńõ»ÆĢ¼£¬×īŗóÓĆ¼ÓČȵÄCuOŗĶ³ĪĒåŹÆ»ŅĖ®¼ģŃéCO£»ÓÉÓŚ²ŻĖįŌŚ100”ꏱæŖŹ¼Éż»Ŗ£¬157”ꏱ“óĮæÉż»Ŗ£¬²ŻĖįÕōĘųŌŚµĶĪĀĻĀæÉĄäÄżĪŖ¹ĢĢ壬²ŻĖįŅ²ÄÜŹ¹³ĪĒåŹÆ»ŅĖ®±ä»ė×Ē£¬¹Ź¼ģŃéCO2Ö®Ē°±ŲŠė³żČ„²ŻĖįÕōĘų£»¼ģŃéCOÖ®Ē°±ŲŠėĶźČ«³żČ„CO2£»ĖłŅŌŅĒĘ÷µÄĮ¬½ÓĖ³ŠņĪŖ£ŗACDEDBD£¬ ¹Ź“š°øĪŖ£ŗA C B D£»
£¬¼ģŃ鏱ӦøĆĻČÓĆĪŽĖ®ĮņĖįĶ¼ģŃéĖ®ÕōĘų£¬Č»ŗóÓĆ³ĪĒåŹÆ»ŅĖ®¼ģŃ鶞Ńõ»ÆĢ¼£¬×īŗóÓĆ¼ÓČȵÄCuOŗĶ³ĪĒåŹÆ»ŅĖ®¼ģŃéCO£»ÓÉÓŚ²ŻĖįŌŚ100”ꏱæŖŹ¼Éż»Ŗ£¬157”ꏱ“óĮæÉż»Ŗ£¬²ŻĖįÕōĘųŌŚµĶĪĀĻĀæÉĄäÄżĪŖ¹ĢĢ壬²ŻĖįŅ²ÄÜŹ¹³ĪĒåŹÆ»ŅĖ®±ä»ė×Ē£¬¹Ź¼ģŃéCO2Ö®Ē°±ŲŠė³żČ„²ŻĖįÕōĘų£»¼ģŃéCOÖ®Ē°±ŲŠėĶźČ«³żČ„CO2£»ĖłŅŌŅĒĘ÷µÄĮ¬½ÓĖ³ŠņĪŖ£ŗACDEDBD£¬ ¹Ź“š°øĪŖ£ŗA C B D£»
¢Ś²ŻĖįÕōĘųÄÜŹ¹³ĪĒåŹÆ»ŅĖ®±ä»ė×Ē£¬A×°ÖƵÄ×÷ÓĆŹĒ³żČ„»ģŗĻĘųĢåÖŠµÄ²ŻĖįÕōĘų£¬µ±×°ÖĆBÖŠŗŚÉ«¹ĢĢå±ä³ÉŗģÉ«£¬ĒŅBŗó×°ÖĆDÖŠ³ĪĒåŹÆ»ŅĖ®±ä»ė×Ē£¬ŌņÖ¤Ć÷»ģŗĻĘųĢåÖŠŗ¬ÓŠCO£¬¹Ź“š°øĪŖ£ŗ³żČ„»ģŗĻĘųĢåÖŠµÄ²ŻĖįÕōĘų£»BÖŠµÄ¹ĢĢåÓÉŗŚÉ«±äĪŖ×ĻŗģÉ«£¬BŗóD×°ÖĆÖŠµÄ³ĪĒåŹÆ»ŅĖ®±ä»ė×Ē£»
¢ŪŅ»Ńõ»ÆĢ¼ÓŠ¶¾ĪŪČ¾æÕĘų£¬ŠčŅŖ½ųŠŠĪ²Ęų“¦Ąķ£¬Ņ»Ńõ»ÆĢ¼Ī²ĘųµÄ“¦Ąķ·½·ØĪŖµćČ¼»ņÓĆĘųĒņŹÕ¼Æ£¬¹Ź“š°øĪŖ£ŗĪŽCOµÄĪ²Ęų“¦Ąķ×°ÖĆ£»
£Ø3£©![]() ½«²ŻĖį¾§ĢåČÜÓŚŗ¬·ÓĢŖµÄNaOHČÜŅŗÖŠ£¬ČÜŅŗĶŹÉ«£¬Ö»ÄÜĖµĆ÷Ėį¼ī·“Ó¦£¬²»ÄÜĖµĆ÷²ŻĖįŹĒČõĖį£¬¹Źa“ķĪó£»
½«²ŻĖį¾§ĢåČÜÓŚŗ¬·ÓĢŖµÄNaOHČÜŅŗÖŠ£¬ČÜŅŗĶŹÉ«£¬Ö»ÄÜĖµĆ÷Ėį¼ī·“Ó¦£¬²»ÄÜĖµĆ÷²ŻĖįŹĒČõĖį£¬¹Źa“ķĪó£»
![]() ²ā¶Ø²ŻĖįÄĘ
²ā¶Ø²ŻĖįÄĘ![]() ČÜŅŗµÄpH£¬ČōĻŌ¼īŠŌ£¬Ö¤Ć÷²ŻĖįøłĄė×ÓĖ®½ā£¬Ö¤Ć÷²ŻĖįŹĒČõĖį£¬¹ŹbÕżČ·£»
ČÜŅŗµÄpH£¬ČōĻŌ¼īŠŌ£¬Ö¤Ć÷²ŻĖįøłĄė×ÓĖ®½ā£¬Ö¤Ć÷²ŻĖįŹĒČõĖį£¬¹ŹbÕżČ·£»
![]() µČĢå»żµČÅØ¶ČµÄ²ŻĖįČÜŅŗŗĶĻ”ĮņĖį£¬²ŻĖįŗĶĮņĖį¶¼ĪŖ¶žŌŖĖį£¬ĻūŗļīµÄÄÜĮ¦ĻąµČ£¬¹Źc“ķĪó£»
µČĢå»żµČÅØ¶ČµÄ²ŻĖįČÜŅŗŗĶĻ”ĮņĖį£¬²ŻĖįŗĶĮņĖį¶¼ĪŖ¶žŌŖĖį£¬ĻūŗļīµÄÄÜĮ¦ĻąµČ£¬¹Źc“ķĪó£»
![]() pH=2µÄ²ŻĖįČÜŅŗŗĶĻ”ĮņĖį£¬·Ö±šĻ”ŹĶ100±¶ŗóĒ°ÕßpHŠ”£¬ĖµĆ÷¼ÓĖ®Ļ”ŹĶ“Ł½ų²ŻĖįµēĄė£¬Ö¤Ć÷²ŻĖįČÜŅŗÖŠ“ęŌŚµēĄėĘ½ŗā£¬²ŻĖįĪŖČõĖį£¬¹ŹdÕżČ·£»
pH=2µÄ²ŻĖįČÜŅŗŗĶĻ”ĮņĖį£¬·Ö±šĻ”ŹĶ100±¶ŗóĒ°ÕßpHŠ”£¬ĖµĆ÷¼ÓĖ®Ļ”ŹĶ“Ł½ų²ŻĖįµēĄė£¬Ö¤Ć÷²ŻĖįČÜŅŗÖŠ“ęŌŚµēĄėĘ½ŗā£¬²ŻĖįĪŖČõĖį£¬¹ŹdÕżČ·£»
![]() ½«²ŻĖįČÜŅŗ¼ÓČė
½«²ŻĖįČÜŅŗ¼ÓČė![]() ČÜŅŗÖŠ£¬ÓŠ
ČÜŅŗÖŠ£¬ÓŠ![]() ·Å³ö£¬Ö»ÄÜĖµĆ÷²ŻĖįĖįŠŌ“óÓŚĢ¼Ėį£¬µ«²»ÄÜÖ¤Ć÷²ŻĖįŹĒČõĖį£¬¹Źe“ķĪó£»
·Å³ö£¬Ö»ÄÜĖµĆ÷²ŻĖįĖįŠŌ“óÓŚĢ¼Ėį£¬µ«²»ÄÜÖ¤Ć÷²ŻĖįŹĒČõĖį£¬¹Źe“ķĪó£»
¹Ź“š°øĪŖ£ŗbd£»
£Ø4£©ÓÉŹż¾ŻæÉÖŖ£¬Ka1>Ka2>Kb£¬øł¾ŻŌ½ČõŌ½Ė®½ā£¬![]() ÖŠNH4+Ė®½ā³Ģ¶Čøü“ó£¬ČÜŅŗĻŌĖįŠŌ£¬
ÖŠNH4+Ė®½ā³Ģ¶Čøü“ó£¬ČÜŅŗĻŌĖįŠŌ£¬![]() £»¹Ź“š°øĪŖ£ŗ
£»¹Ź“š°øĪŖ£ŗ![]() £»
£»
£Ø5£©¢ŁøßĆĢĖį¼Ų¾ßÓŠĒæŃõ»ÆŠŌ£¬°Ń²ŻĖįÖŠµÄC“Ó![]() ¼ŪŃõ»Æ³É
¼ŪŃõ»Æ³É![]() ¼ŪµÄ¶žŃõ»ÆĢ¼£¬MnŌŖĖŲ“Ó
¼ŪµÄ¶žŃõ»ÆĢ¼£¬MnŌŖĖŲ“Ó![]() ¼Ū±ä»Æµ½
¼Ū±ä»Æµ½![]() ¼ŪµÄĆĢĄė×Ó£¬ÓÉÓŚ²ŻĖį·Ö×ÓÖŠÓŠ2øöCŌ×Ó£¬ĖłŅŌøßĆĢĖį¼ŲÓė²ŻĖįµÄ·“Ó¦±ČĄżĪŖ5£ŗ2£¬¹Ź·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ
¼ŪµÄĆĢĄė×Ó£¬ÓÉÓŚ²ŻĖį·Ö×ÓÖŠÓŠ2øöCŌ×Ó£¬ĖłŅŌøßĆĢĖį¼ŲÓė²ŻĖįµÄ·“Ó¦±ČĄżĪŖ5£ŗ2£¬¹Ź·“Ó¦µÄĄė×Ó·½³ĢŹ½ĪŖ£ŗ![]() £¬¹Ź“š°øĪŖ£ŗ
£¬¹Ź“š°øĪŖ£ŗ![]() £»
£»
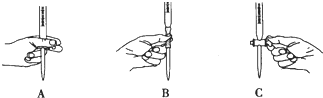
¢ŚKMnO4ČÜŅŗ¾ßÓŠĒæŃõ»ÆŠŌ£¬Ó¦ÓĆĖįŹ½µĪ¶Ø¹ÜŹ¢·Å£¬øł¾ŻµĪ¶Ø¹ÜµÄŹ¹ÓĆ¹ęŌņ£¬µĪ¶ØŹ±£¬×óŹÖæŲÖĘĖįŹ½µĪ¶Ø¹ÜµÄ»īČū£¬·ĄÖ¹»īČū±»ŅāĶā“ņæŖ£¬¼“ČēĶ¼AĖłŹ¾²Ł×÷£»¹Ź“š°øĪŖ£ŗA£»
¢ŪµĪ¶ØČż“Ī·Ö±šĻūŗĵÄ![]() ČÜŅŗµÄĢå»żŹĒ
ČÜŅŗµÄĢå»żŹĒ![]() ”¢
Ӣ![]() Ӣ
”¢![]() £¬ĻūŗĵÄ
£¬ĻūŗĵÄ![]() ČÜŅŗµÄĢå»żĘ½¾łĪŖŹĒ
ČÜŅŗµÄĢå»żĘ½¾łĪŖŹĒ![]() £¬
£¬
![]() øßĆĢĖį¼Ų
øßĆĢĖį¼Ų![]() £¬Ōņ£ŗ
£¬Ōņ£ŗ
![]()
2mol 5mol
![]()
½āµĆ![]() £¬
£¬
¹Ź“š°øĪŖ£ŗ![]() ”£
ӣ



| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚŅ»¶ØĪĀ¶ČĻĀ£¬Ļņa LĆܱÕČŻĘ÷ÖŠ¼ÓČė1molXĘųĢåŗĶ2 molYĘųĢ壬·¢ÉśČēĻĀ·“Ó¦£ŗX(g) + 2Y(g)![]() 2Z(g)“Ė·“Ó¦“ļµ½Ę½ŗāµÄ±źÖ¾ŹĒ
2Z(g)“Ė·“Ó¦“ļµ½Ę½ŗāµÄ±źÖ¾ŹĒ
A.ČŻĘ÷ÄŚŃ¹Ēæ²»Ėꏱ¼ä±ä»Æ
B.ČŻĘ÷ÄŚø÷ĪļÖŹµÄÅضČĶźČ«ĻąĶ¬
C.ČŻĘ÷ÄŚX”¢Y”¢ZµÄÅضČÖ®±ČĪŖ1”Ć2”Ć2
D.µ„Ī»Ź±¼äĻūŗÄ0.1molXĶ¬Ź±Éś³É0.2molZ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æČČ»Æѧ·½³ĢŹ½C(s)£«H2O(g) ![]() CO(g)£«H2(g)£»”÷H £½+131.3kJ/mol±ķŹ¾£Ø £©
CO(g)£«H2(g)£»”÷H £½+131.3kJ/mol±ķŹ¾£Ø £©
A. Ģ¼ŗĶĖ®·“Ó¦ĪüŹÕ131.3kJÄÜĮæ
B. 1molĢ¼ŗĶ1molĖ®·“Ӧɜ³ÉŅ»Ńõ»ÆĢ¼ŗĶĒāĘų²¢ĪüŹÕ131.3kJČČĮæ
C. 1mol¹ĢĢ¬Ģ¼ŗĶ1molĖ®ÕōĘųĶźČ«·“Ӧɜ³ÉŅ»Ńõ»ÆĢ¼ĘųĢåŗĶĒāĘų£¬²¢ĪüČČ131.3kJČČĮæ
D. 1øö¹ĢĢ¬Ģ¼Ō×ÓŗĶ1·Ö×ÓĖ®ÕōĘų·“Ó¦ĪüČČ131.1kJ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ![]() £Ø»·Īģ¶žĻ©£©ČŻŅ×·¢Éś¾ŪŗĻÉś³É¶ž¾ŪĢ壬øĆ·“Ó¦ĪŖæÉÄę·“Ó¦”£²»Ķ¬ĪĀ¶ČĻĀ£¬ČÜŅŗÖŠ»·Īģ¶žĻ©ÅضČÓė·“Ó¦Ź±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
£Ø»·Īģ¶žĻ©£©ČŻŅ×·¢Éś¾ŪŗĻÉś³É¶ž¾ŪĢ壬øĆ·“Ó¦ĪŖæÉÄę·“Ó¦”£²»Ķ¬ĪĀ¶ČĻĀ£¬ČÜŅŗÖŠ»·Īģ¶žĻ©ÅضČÓė·“Ó¦Ź±¼äµÄ¹ŲĻµČēĶ¼ĖłŹ¾£¬ĻĀĮŠĖµ·Ø²»ÕżČ·µÄŹĒ£Ø £©
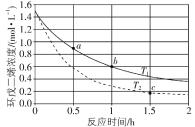
A.T1Š”ÓŚT2
B.aµćµÄ·“Ó¦ĖŁĀŹŠ”ÓŚcµćµÄ·“Ó¦ĖŁĀŹ
C.aµćµÄÕż·“Ó¦ĖŁĀŹ“óÓŚbµćµÄÄę·“Ó¦ĖŁĀŹ
D.bµćŹ±¶ž¾ŪĢåµÄÅضČĪŖ0.45 mol”¤L1
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬ÓĆ0.100mol”¤L£1NaOHČÜŅŗµĪ¶Ø10mL0.100mol”¤L£1H3PO4ČÜŅŗ£¬ĒśĻßČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ
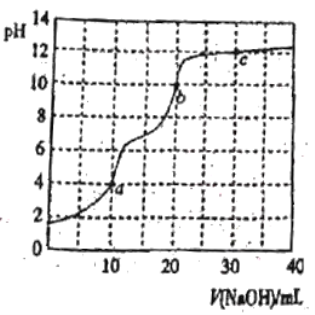
A.µĪ¶ØÖÕµćaæÉŃ”Ōń·ÓĢŖ×÷ÖøŹ¾¼Į
B.cµćČÜŅŗÖŠc(Na£«)>3c(![]() )£«2c(
)£«2c(![]() )£«c(
)£«c(![]() )
)
C.bµćČÜŅŗÖŠc(![]() )>c(
)>c(![]() )>c(
)>c(![]() )
)
D.a”¢b”¢cČżµćÖŠĖ®µÄµēĄė³Ģ¶Č×īŠ”µÄŹĒc
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĢ¼Ėį¶žŅŅõ„(![]() )³£ĪĀĻĀĪŖĪŽÉ«Ēå³ŗŅŗĢ唣Ö÷ŅŖÓĆ×÷ĻõĖįĻĖĪ¬ĖŲ”¢Ź÷Ö¬ŗĶŅ»Š©Ņ©ĪļµÄČܼĮ£¬»ņÓŠ»śŗĻ³ÉµÄÖŠ¼äĢ唣ĻÖÓĆĻĀĮŠ×°ÖĆÖʱøĢ¼Ėį¶žŅŅõ„”£
)³£ĪĀĻĀĪŖĪŽÉ«Ēå³ŗŅŗĢ唣Ö÷ŅŖÓĆ×÷ĻõĖįĻĖĪ¬ĖŲ”¢Ź÷Ö¬ŗĶŅ»Š©Ņ©ĪļµÄČܼĮ£¬»ņÓŠ»śŗĻ³ÉµÄÖŠ¼äĢ唣ĻÖÓĆĻĀĮŠ×°ÖĆÖʱøĢ¼Ėį¶žŅŅõ„”£
»ÆѧŹ½ | ČŪµć/”ę | ·Šµć/”ę | ĪļĄķŠŌÖŹ |
COCl2 | -118 | 8.2 | Ī¢ČÜÓŚĖ®£¬ČÜÓŚ·¼Ģž”¢±½”¢ĖÄĀČ»ÆĢ¼”¢ĀČ·Ā”¢ŅŅĖįµČ¶ąŹżÓŠ»śČܼĮ£¬ÓöĖ®ŃøĖŁĖ®½ā£¬Éś³ÉĀČ»ÆĒā |
SO3 | 16.8 | 44.8 | ČÜÓŚĖ®£¬²¢ÓėĖ®·“Ӧɜ³ÉĮņĖįŗĶ·Å³ö“óĮæµÄČČ |
SO2Cl2 | -54.1 | 69.1 | ČÜÓŚŅŅĖį”¢±½£¬ÓėĖ®·“Ӧɜ³ÉH2SO4ŗĶHCl |
CCl4 | -22.9 | 76.8 | Ī¢ČÜÓŚĖ®£¬Ņ×ČÜÓŚ¶ąŹżÓŠ»śČܼĮ |
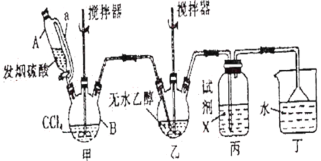
»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)¼××°ÖĆÖ÷ŅŖÓĆÓŚÖʱø¹āĘų(COCl2)£¬ĻČ½«ŅĒĘ÷BÖŠµÄĖÄĀČ»ÆĢ¼¼ÓČČÖĮ55”«60”ę£¬ŌŁ»ŗ»ŗµĪ¼Ó·¢ŃĢĮņĖį”£
¢ŁŅĒĘ÷BµÄĆū³ĘŹĒ__________”£
¢ŚŅĒĘ÷AµÄ²ąµ¼¹ÜaµÄ×÷ÓĆŹĒ__________”£
(2)ŹŌ¼ĮXŹĒ__________£¬Ęä×÷ÓĆŹĒ__________”£
(3)¶”×°ÖĆ³żĮĖĪüŹÕCOCl2Ķā£¬»¹ÄÜĪüŹÕµÄĘųĢåŹĒ__________(Ģī»ÆѧŹ½)”£ŅĒĘ÷BÖŠĖÄĀČ»ÆĢ¼Óė·¢ŃĢĮņĖį(ÓĆSO3±ķŹ¾)·“Ӧֻɜ³ÉĮ½ÖÖĪļÖŹµÄĮæĪŖ1£ŗ1µÄ²śĪļ£¬ĒŅ¾łŅ×ÓėĖ®·“Ó¦£¬Š“³öøĆ·“Ó¦»Æѧ·½³ĢŹ½£ŗ__________”£
(4)ĪŽĖ®ŅŅ“¼Óė¹āĘų·“Ӧɜ³ÉĀČ¼×ĖįŅŅõ„£¬ŌŁ¼ĢŠųÓėŅŅ“¼·“Ӧɜ³ÉĢ¼Ėį¶žŅŅõ„”£
¢ŁŠ“³öĪŽĖ®ŅŅ“¼Óė¹āĘų·“Ӧɜ³ÉĀČ¼×ĖįŅŅõ„µÄ»Æѧ·½³ĢŹ½£ŗ__________”£
¢ŚČōĘšŹ¼Ķ¶Čė92.0gĪŽĖ®ŅŅ“¼£¬×īÖÕµĆµ½Ģ¼Ėį¶žŅŅõ„94.4g£¬ŌņĢ¼Ėį¶žŅŅõ„µÄ²śĀŹŹĒ__________(ČżĪ»ÓŠŠ§Źż×Ö)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻÖÓŠ·“Ó¦aA(g)£«bB(g)![]() pC(g)£¬“ļµ½Ę½ŗāŗ󣬵±ÉżøßĪĀ¶ČŹ±£¬BµÄ×Ŗ»ÆĀŹ±ä“ó£»µ±¼õŠ”Ń¹ĒæŹ±£¬»ģŗĻĢåĻµÖŠCµÄÖŹĮæ·ÖŹżŅ²¼õŠ”£¬Ōņ£ŗ
pC(g)£¬“ļµ½Ę½ŗāŗ󣬵±ÉżøßĪĀ¶ČŹ±£¬BµÄ×Ŗ»ÆĀŹ±ä“ó£»µ±¼õŠ”Ń¹ĒæŹ±£¬»ģŗĻĢåĻµÖŠCµÄÖŹĮæ·ÖŹżŅ²¼õŠ”£¬Ōņ£ŗ
£Ø1£©øĆ·“Ó¦µÄÄę·“Ó¦ŹĒ________ČČ·“Ó¦£¬ĒŅa£«b________p(Ģī”°>”±”°<”±»ņ”°£½”±)”£
£Ø2£©¼õŃ¹Ź±£¬AµÄÖŹĮæ·ÖŹż________(Ģī”°Ōö“ó”±”°¼õŠ””±»ņ”°²»±ä”±£¬ĻĀĶ¬)£¬Õż·“Ó¦ĖŁĀŹ________”£
£Ø3£©Čō¼ÓČėB(Ģå»ż²»±ä)£¬ŌņAµÄ×Ŗ»ÆĀŹ________£¬BµÄ×Ŗ»ÆĀŹ________”£
£Ø4£©ČōÉżøßĪĀ¶Č£¬ŌņĘ½ŗāŹ±£¬B”¢CµÄÅضČÖ®±Čc(B)/c(C) ½«________”£
£Ø5£©Čō¼ÓČė“߻ƼĮ£¬Ę½ŗāŹ±ĘųĢå»ģŗĻĪļµÄ×ÜĪļÖŹµÄĮæ________”£
£Ø6£©ČōBŹĒÓŠÉ«ĪļÖŹ£¬ A”¢C¾łĪŖĪŽÉ«ĪļÖŹ£¬Ōņ¼ÓČėC(Ģå»ż²»±ä)Ź±»ģŗĻĪļµÄŃÕÉ«________£¬¶ųĪ¬³ÖČŻĘ÷ÄŚĘųĢåµÄŃ¹Ēæ²»±ä£¬³äČėÄŹĘųŹ±£¬»ģŗĻĪļµÄŃÕÉ«________”£(Ģī”°±äĒ³”±”°±äÉī”±»ņ”°²»±ä”±)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ³£ĪĀĻĀ£¬Ļņ20mL 0.1mol/L°±Ė®ÖŠµĪ¼ÓŅ»¶ØÅØ¶ČµÄĻ”ŃĪĖį£¬ČÜŅŗÖŠÓÉĖ®µēĄėµÄĒāĄė×ÓÅضČĖę¼ÓČėŃĪĖįĢå»żµÄ±ä»ÆČēĶ¼ĖłŹ¾”£ŌņĻĀĮŠĖµ·ØÕżČ·µÄŹĒ(””””)
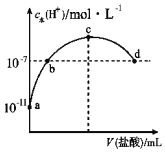
A.³£ĪĀĻĀ£¬0.1 mol/L°±Ė®ÖŠ£¬c (OH©)£½1”Į10©5 mol/L
B.bµć“ś±ķČÜŅŗ³ŹÖŠŠŌ
C.cµćČÜŅŗÖŠc(NH4+)£½c(Cl©)
D.dµćČÜŅŗÖŠ£ŗc(Cl©)£¾c(NH4+)£¾c(OH©)£¾c(H+)
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĻĀ±ķŹĒŌŖĖŲÖÜĘŚ±ķµÄŅ»²æ·Ö£¬±ķÖŠĖłĮŠµÄ×ÖÄø·Ö±š“ś±ķŅ»ÖÖŌŖĖŲ”£
A | |||||||||||||||||
B | C | D | E | F | T | ||||||||||||
G | H | I | J | K | L | ||||||||||||
M | N | O | |||||||||||||||
ŹŌ»Ų“šĻĀĮŠĪŹĢā£Ø×¢Ņā£ŗĆæĪŹÖŠµÄ×ÖÄø“śŗÅĪŖÉĻ±ķÖŠµÄ×ÖÄø“śŗÅ£¬²¢·ĒĪŖŌŖĖŲ·ūŗÅ£©
(1)NµÄµ„ÖŹŗĶĖ®ÕōĘų·“Ó¦ÄÜÉś³É¹ĢĢåX£¬ŌņIµÄµ„ÖŹÓėX·“Ó¦µÄ»Æѧ·½³ĢŹ½_______”£
(2)DµÄĘųĢ¬Ēā»ÆĪļµÄVSEPRÄ£ŠĶµÄĆū³ĘĪŖ_______”£
(3)ÓÉA”¢C”¢DŠĪ³ÉµÄACD·Ö×ÓÖŠ£¬¦Ņ¼üŗĶ¦Š¼üøöŹż±Č= _______________”£
(4)ŅŖÖ¤Ć÷Ģ«ŃōÉĻŹĒ·ńŗ¬ÓŠR ŌŖĖŲ£¬æɲÉÓƵķ½·ØŹĒ__________________________”£
(5)ŌŖĖŲMµÄ»ÆŗĻĪļ(ME2L2)ŌŚÓŠ»śŗĻ³ÉÖŠæÉ×÷Ńõ»Æ¼Į»ņĀČ»Æ¼Į£¬ÄÜÓėŠķ¶ąÓŠ»śĪļ·“Ó¦”£»Ų“šĪŹĢā£ŗ
¢ŁME2L2³£ĪĀĻĀĪŖÉīŗģÉ«ŅŗĢ壬ÄÜÓėCCl4”¢CS2µČ»„ČÜ£¬¾Ż“ĖæÉÅŠ¶ĻME2L2ŹĒ_________£ØĢī”°¼«ŠŌ”±»ņ”°·Ē¼«ŠŌ”±£©·Ö×Ó”£
¢Ś½«NŗĶOµÄµ„ÖŹÓƵ¼ĻßĮ¬½Óŗó²åČėDµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļÅØČÜŅŗÖŠ£¬æÉÖĘ³ÉŌµē³Ų£¬Ōņ×é³Éøŗ¼«²ÄĮĻµÄŌŖĖŲµÄĶāĪ§µē×Ó¹ģµĄ±ķŹ¾Ź½ĪŖ______________________”£
(6)ĶłO2£«ČÜŅŗÖŠ¼ÓČė°±Ė®£¬ŠĪ³ÉĄ¶É«³Įµķ£¬¼ĢŠų¼ÓČė°±Ė®£¬ÄŃČÜĪļČܽā±ä³ÉĄ¶É«ĶøĆ÷ČÜŅŗ£¬Š“³ö³ĮµķČܽāµÄĄė×Ó·½³ĢŹ½_____”£
(7)ČōF ”¢KĮ½ÖÖŌŖĖŲŠĪ³ÉµÄ»ÆŗĻĪļÖŠÖŠŠÄŌ×ӵļŪµē×ÓČ«²æ²ĪÓė³É¼ü£¬ŌņøĆ»ÆŗĻĪļµÄæռ乹ŠĶµÄĆū³ĘĪŖ___”£
(8)ČēĶ¼ĖÄĢõÕŪĻß·Ö±š±ķŹ¾¢ōA×唢¢õA×唢¢öA×唢¢÷A×åŌŖĖŲĘųĢ¬Ēā»ÆĪļ·Šµć±ä»Æ£¬ŌņEµÄĒā»ÆĪļĖłŌŚµÄÕŪĻߏĒ__£ØĢīm”¢n”¢x»ņy£©”£
(9)1183 KŅŌĻĀ“æN¾§ĢåµÄ»ł±¾½į¹¹µ„ŌŖČē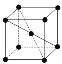 ĖłŹ¾£¬1183 KŅŌÉĻ×Ŗ±äĪŖ
ĖłŹ¾£¬1183 KŅŌÉĻ×Ŗ±äĪŖ ĖłŹ¾½į¹¹µÄ»ł±¾½į¹¹µ„ŌŖ”£ŌŚ1183 KŅŌĻĀµÄ¾§ĢåÖŠ£¬æÕ¼äĄūÓĆĀŹĪŖ____£»ŌŚ1183 KŅŌÉĻµÄ¾§ĢåÖŠ£¬ÓėNŌ×ÓµČ¾ąĄėĒŅ×ī½üµÄNŌ×ÓŹżĪŖ____£¬¾§Ģå¶Ń»ż·½Ź½µÄĆū³ĘĪŖ_____”£
ĖłŹ¾½į¹¹µÄ»ł±¾½į¹¹µ„ŌŖ”£ŌŚ1183 KŅŌĻĀµÄ¾§ĢåÖŠ£¬æÕ¼äĄūÓĆĀŹĪŖ____£»ŌŚ1183 KŅŌÉĻµÄ¾§ĢåÖŠ£¬ÓėNŌ×ÓµČ¾ąĄėĒŅ×ī½üµÄNŌ×ÓŹżĪŖ____£¬¾§Ģå¶Ń»ż·½Ź½µÄĆū³ĘĪŖ_____”£
²éæ““š°øŗĶ½āĪö>>
¹ś¼ŹŃ§Š£ÓÅŃ” - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com