
【题目】二水合草酸亚铁(FeC2O42H2O)是制备某种铁锂电池最常用的原料。国内某科研团队以氮气为保护气,对二水合草酸亚铁的受热分解情况进行研究,生成的气体只含CO、CO2和H2O(g),得到固体质量与加热温度的变化曲线如图所示。下列说法正确的是
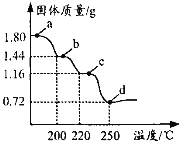
A.b点的固体成份为FeC2O4H2O
B.b→c 的方程式为 FeC2O4![]() FeCO3+CO↑
FeCO3+CO↑
C.从a→d, 生成的CO、CO2的物质的量相等
D.加热至250℃以上,固体质量略有增加,可能是因为FeO与CO反应生成了 Fe3C
【答案】BC
【解析】
A项、1.80gFeC2O42H2O的物质的量为![]() =0.01mol,由图可知,减少的质量为水的质量,减少水的物质的量为
=0.01mol,由图可知,减少的质量为水的质量,减少水的物质的量为![]() =0.02mol,说明结晶水已全部失去,b点的固体成份为FeC2O4,故A错误;
=0.02mol,说明结晶水已全部失去,b点的固体成份为FeC2O4,故A错误;
B项、由铁原子个数守恒,可知1.16g固体中铁的质量为0.56g,阴离子的质量为(1.16—0.56)g=0.60g,损失的质量为(1.44—1.16)g=0.28g,则b→c的反应FeC2O4为受热分解生成FeCO3和CO,故B正确;
C项、b→c的反应中生成一氧化碳的物质的量为![]() =0.01mol,c→d的反应中生成一氧化碳的物质的量为
=0.01mol,c→d的反应中生成一氧化碳的物质的量为![]() =0.01mol,故C正确;
=0.01mol,故C正确;
D项、加热至250℃以上,固体质量略有增加,可能是因为FeO与空气中氧气反应生成了Fe3O4或Fe2O3,故D错误;
故选BC。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于实验室制氯气的说法中错误的是( )
A.该反应是一个氧化还原反应,其中二氧化锰是氧化剂
B.每生成1mol氯气,就要转移2mol电子
C.该反应的离子方程式为MnO2+4H++4Cl-![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
D.该方法是瑞典化学家舍勒最先发现的
查看答案和解析>>
科目:高中化学 来源: 题型:
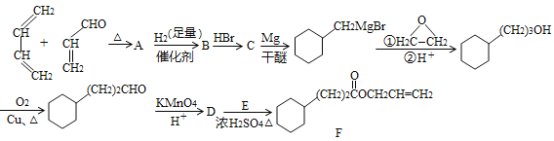
【题目】菠萝酯F是一种具有菠萝香味的赋香剂,其合成路线如图:
已知:①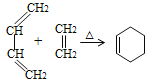
②RMgBr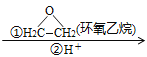 RCH2CH2OH+
RCH2CH2OH+![]()
(1)A中所含官能团![]() 名称是__,B的结构简式为__。
名称是__,B的结构简式为__。
(2)由A生成B的反应类型是__。
(3)写出D和E反应生成F的化学方程式__。
(4)D中含有环己基(只有一个侧键)能发生银镜反应的同分异构体的结构简式为__。
(5)结合题给信息,以乙烯为原料制备1-丁醇,设计合成路线(其他试剂任选)__。
合成路线流程图示例:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】MnCO3可用作电器元件材料,也可作为瓷釉、颜料的制作原料。工业上用酸性含锰废水(主要含Mn2+、Cl-、H+、Fe2+、Cu2+)制备MnCO3:
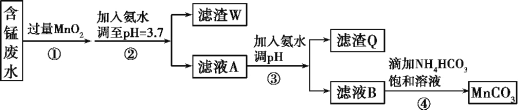
已知:几种金属离子沉淀的pH如下表。
金属离子 | Fe2+ | Fe3+ | Cu2+ | Mn2+ |
开始沉淀的pH | 7.5 | 3.2 | 5.2 | 8.8 |
完全沉淀的pH | 9.7 | 3.7 | 6.4 | 10.4 |
回答下列问题:
(1)①中加入过量MnO2的作用是___,滤渣W的成分是___。
(2)过程③中,调pH的目的是___。
(3)过程④中有CO2生成,则生成MnCO3的离子方程式是___。
(4)过程④中得到纯净MnCO3的操作方法是___,该过程中副产品的化学式是___。
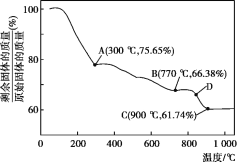
(5)MnCO3在空气中加热易转化为不同价态的锰的氧化物,其固体残留率随温度的变化如图所示。则300℃时,剩余固体中n(Mn)∶n(O)为___;图中点D对应固体的成分为___(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】美国斯坦福大学的工程师设计出一种从污水“提取”潜在电能的新型微生物电池,该电池能将生活污水中的有机物分解同时发电,电池结构如图所示。已知a电极为惰性材料,b电极为Ag2O。下列说法不正确的是( )
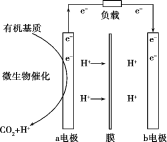
A.a电极是负极,b电极是正极
B.b电极发生的反应是Ag2O+2e-+2H+=2Ag+H2O
C.a电极每生成标准状况下2.24LCO2,可向b电极转移0.1mol电子
D.高温条件下,该电池不能正常工作
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃是重要的有机化工原料。实验室主要用浓硫酸或浓磷酸作催化剂使醇脱水制取烯烃。某同学使用环己醇脱水制备环己烯。设计方案如下:
(一)主要仪器和试剂
仪器:50mL圆底烧瓶、分馏柱、直形冷凝管、10mL量筒、分液漏斗、100mL锥形瓶、蒸馏头、接液管。
试剂:10.0g(10.4mL,0.1mol)环己醇、5mL浓磷酸、氯化钠、无水氯化钙、5%碳酸钠水溶液。
(二)查阅实验所涉及的反应物、催化剂、产物的各种物理性质,列表如下:
化学物质 | 相对分子 质量 | 相对密度/ g·cm-3 | 沸点/℃ | 溶解性 |
环己醇 | 100 | 0.96 | 161.1 | 稍溶于水 |
磷酸(85%) | 98 | 1.83 | 213 | 易溶于水 |
环己烯 | 82 | 0.89 | 83.3 | 微溶于水 |
(三)实验流程

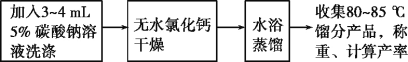
请回答:
(1)加热过程中,若忘记加沸石,应如何操作?___
(2)将粗产品分去水层所需要用到的主要实验仪器是___。
(3)本实验用浓磷酸代替浓硫酸的优点:___。
(4)该实验的主要副产物为___(填物质名称)。
(5)在提纯环己烯时,用等体积的饱和食盐水,而不用水的原因是___。加入3~4mL5%碳酸钠溶液的目的是___。
(6)水浴蒸馏最后得到7.0g产品,则反应的产率为___(保留2位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.水电离的c(H+)=10-13 mol/L 的溶液中:Na+、K+、![]() 、
、![]()
B.pH=7的溶液中:Na+、Fe3+、Cl-、![]()
C.常温下的溶液中:Cl-、Al3+、Na+、![]()
D.c(H+)=1×10-12mol/L的溶液中:K+、ClO-、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、三种元素,已知C原子最外层电子数为次外层电子数的3倍;B和C原子核外电子层数相等,而最外层电子数之和为10;A、C能形成AC型化合物,A2+离子和B原子电子层数也相同。回答:
(1)画出A2+离子的结构示意图 _____________________;
(2)A、B、C三元素符号分别为___________ 、_____________ 、__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2是一种杀菌消毒效率高、二次污染小的水处理剂,实验室中可通过以下反应制得:2KClO3+H2C2O4+H2SO4![]() 2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
2ClO2↑+K2SO4+2CO2↑+2H2O据此,下列说法不正确的是( )
A. KClO3发生还原反应
B. H2C2O4在反应中被氧化
C. H2C2O4的氧化性强于C1O2的氧化性
D. 每1mol C1O2生成,该反应转移的电子数约为6.02×1023
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com