
【题目】菠萝酯F是一种具有菠萝香味的赋香剂,其合成路线如图:
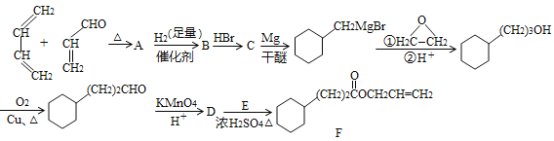
已知:①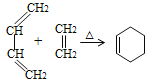
②RMgBr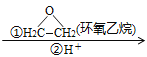 RCH2CH2OH+
RCH2CH2OH+![]()
(1)A中所含官能团![]() 名称是__,B的结构简式为__。
名称是__,B的结构简式为__。
(2)由A生成B的反应类型是__。
(3)写出D和E反应生成F的化学方程式__。
(4)D中含有环己基(只有一个侧键)能发生银镜反应的同分异构体的结构简式为__。
(5)结合题给信息,以乙烯为原料制备1-丁醇,设计合成路线(其他试剂任选)__。
合成路线流程图示例:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
【答案】碳碳双键、醛基 ![]() 加成(或还原)反应
加成(或还原)反应 ![]() +CH2=CHCH2OH
+CH2=CHCH2OH![]() +H2O
+H2O ![]()
![]()
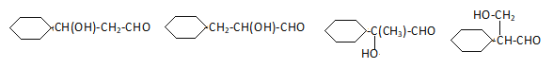 CH3—CH2—Br
CH3—CH2—Br![]() CH3—CH2—MgBr
CH3—CH2—MgBr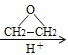 CH3—CH2—CH2—CH2—OH
CH3—CH2—CH2—CH2—OH
【解析】
由题可知,第一步生成A的反应即已知信息中的反应①;因此A的结构即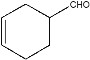 ;A中的碳碳双键和醛基均可以加氢,因此B的结构为
;A中的碳碳双键和醛基均可以加氢,因此B的结构为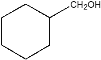 ;醇可以和氢卤酸反应生成相应的卤代烃,因此C的结构为
;醇可以和氢卤酸反应生成相应的卤代烃,因此C的结构为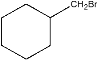 ;由题可知,从
;由题可知,从 到
到 ,发生的反应与已知信息中的反应②相似;D是由
,发生的反应与已知信息中的反应②相似;D是由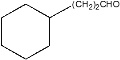 经过酸性高锰酸钾溶液处理后得到的,所以D即
经过酸性高锰酸钾溶液处理后得到的,所以D即 ;D与E反应后生成的F中有酯基,并且二者是在浓硫酸的条件下反应的,所以D与E发生的即酯化反应,E的结构即为
;D与E反应后生成的F中有酯基,并且二者是在浓硫酸的条件下反应的,所以D与E发生的即酯化反应,E的结构即为![]() 。
。
(1)通过分析可知,A为 ,含有的官能团为碳碳双键和醛基;B为
,含有的官能团为碳碳双键和醛基;B为 ;
;
(2)通过分析可知,A生成B的反应即加成反应;
(3)通过分析可知,D和E生成F的反应即酯化反应,方程式为:
 +
+![]()
![]()
 +H2O;
+H2O;
(4)通过分析可知D即为 ,D中含有环己基(只有一个侧链),能发生银镜反应,侧链中含有HCOO-结构,或-OH、-CHO结构,符合要求的同分异构体结构为:
,D中含有环己基(只有一个侧链),能发生银镜反应,侧链中含有HCOO-结构,或-OH、-CHO结构,符合要求的同分异构体结构为: 、
、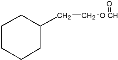 、
、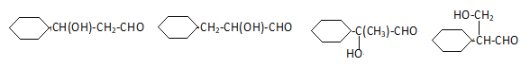 ;
;
(5)原料乙烯中有2个C,产品1-丁醇中有4个碳,涉及碳链增长,所以设计合成路线时需要参考已知信息中的反应②,因此合成路线为:
![]()
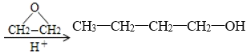 。
。


科目:高中化学 来源: 题型:
【题目】TiCl4是制备钛及其化合物的重要中间体,可利用下列装置在实验室制备TiCl4(夹持装置略去): TiO2+2C+2Cl2![]() TiCl4+2CO
TiCl4+2CO
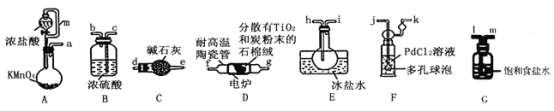
已知:①PdCl2溶液捕获CO时生成Pd单质;②相关数据如下表:
化合物 | 熔点/℃ | 沸点/℃ | 密度/gcm-3 | 溶解性 |
TiCl4 | -25 | 136 | 1.5 | 能溶于有机溶剂:遇水分解生成难溶于水的物质 |
CCl4 | -23 | 76.8 | 1.6 | 难溶于水 |
回答下列问题:
(1)装置A中连通管的作用是______;装置E中使用冰盐水浴的目的是_____________________。
(2)按照气流由左到右的方向,上述装置合理的连接顺序为____________________ (填仪器接口字母);根据完整的实验装置进行实验,实验步骤如下:_____________; 装入药品;向装置A烧瓶中滴加适量浓盐酸,当观察到_________时,加热装置D中陶瓷管;装置E烧瓶中的液体量不再增加时,停止加热,充分冷却。
(3)装置C的作用为___________________。
(4)装置F中发生反应的化学方程式为________________________。
(5)制得的TiCl4中常含有少量CCl4, 从混合液体中分离出TiCl4的操作名称为_______________。
(6)利用如图所示装置测定产品纯度:称取w g TiCl4产品进行实验,向安全漏斗中加入适量蒸馏水,待四氯化钛充分反应后,将烧瓶和安全漏斗中的液体一并转入锥形瓶中,用氢氧化钠溶液调节至中性,滴加几滴0.1 molL-1的K2CrO4溶液作指示剂,用cmol L-1 AgNO3标准溶液滴定至终点( Ag2CrO4为红棕色沉淀,可指示滴定终点),重复滴定两次,平均消耗标准溶液V mL。
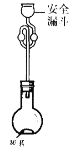
已知:TiCl4 +(2+x)H2O=TiO2xH2O↓+4HCl
①安全漏斗在本实验中的作用除加水外,还有___________。
②根据上述数据计算该产品的纯度为__________。(用含w、c和V的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用“银-Ferrozine”法测室内甲醛含量的原理为:

已知:吸光度与溶液中有色物质的浓度成正比
下列说法正确的是
A. 反应①中参与反应的HCHO为30g时转移电子2mol
B. 可用双氧水检验反应②后的溶液中是否存在Fe3+
C. 生成44.8 LCO2时反应②中参加反应的Ag一定为8mol
D. 理论上测得溶液吸光度越高,HCHO含量也越高
查看答案和解析>>
科目:高中化学 来源: 题型:
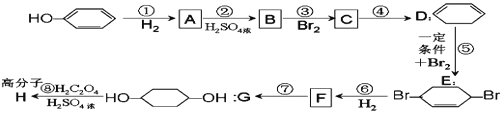
【题目】按以下步骤可从![]() 合成
合成 ![]() (部分试剂和反应条件已去).
(部分试剂和反应条件已去).
请回答下列问题:
(1)A的名称为__________。
(2)分别写出 B、F 的结构简式:B_____、F_____。
(3)反应①~⑦中属于消去反应的是_____,属于加成反应的是_____(填代号)。
(4)根据反应![]() +Br2
+Br2![]() ,写出在同样条件下CH2=CH—CH=CH2 与等物质的量Br2反应的化学方程式:__________________。
,写出在同样条件下CH2=CH—CH=CH2 与等物质的量Br2反应的化学方程式:__________________。
(5)写出第④步的化学方程式_______________。
(6)下列有机物分子中,在核磁共振氢谱图中能给出三种峰(信号)且强度之比为 1∶1∶2 的是_______________。
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸甲酯(CH2=CHCOOCH3)是一种重要的有机化工原料。实验室制备少量丙烯酸甲酯的反应为:CH2=CHCOOH+CH3OH![]() CH2=CHCOOCH3+H2O,步骤如下:
CH2=CHCOOCH3+H2O,步骤如下:
步骤1:在100mL圆底烧瓶中依次加入10.0g丙烯酸、少许碎瓷片、10mL甲醇和2mL浓硫酸,搅拌。
步骤2:如图,连接装置,加热烧瓶中的混合液,用锥形瓶盛接通过分水器分离出的水。当不再有水生成,停止加热。
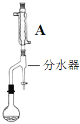
步骤3:反应液冷却后,依次用5%Na2CO3溶液、饱和食盐水、水洗涤。分离出有机相。
步骤4;向有机相中加无水Na2SO4固体,过滤后蒸馏,收集70~90℃馏分。测得丙烯酸甲酯的质量为6.45g。
可能用到的信息:
密度 | 沸点 | 溶解性 | ||
丙烯酸 | 1.05g·cm-3 | 141℃ | 与水互溶,易溶于有机溶剂 | 有毒 |
甲醇 | 0.79g·cm-3 | 65℃ | 与水互溶,易溶于有机溶剂 | 易挥发,有毒 |
丙烯酸甲酯 | 0.95g·cm-3 | 80.5℃ | 难溶于水,易溶于有机溶剂 | 易挥发 |
请回答下列问题:
(1)步骤1中,加入碎瓷片的目的是__。
(2)步骤2中,图中所示装置中仪器A的名称是__,其作用为__。
(3)步骤3中,用5%Na2CO3溶液洗涤后,分离有机相的操作名称为__。
(4)实验中可能生成的有机副产物结构简式为__(填一种即可)。
(5)本实验中丙烯酸甲酯的产率为__%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.lmol/L的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________。
(2)甲组同学取2 mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为____________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2 mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是__________。
(4)丙组同学取5mL0.1mol·L-1KI溶液,加入3mL0.1mol·L-1FeCl3溶液混合,分别取2mL此混合溶液于2支试管中进行如下实验:
①第一支试管中加入1 mLCCl4充分振荡、静置,CCl4层显紫色;
②第二支试管中加入1滴KSCN溶液,溶液变红。
实验②说明:在![]() 过量的情况下,溶液中仍含有________(填离子符号)。
过量的情况下,溶液中仍含有________(填离子符号)。
(5)丁组同学向盛有少量H2O2溶液的试管中加入几滴酸化的FeCl2溶液,溶液变成棕黄色,发生反应的离子方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是
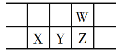
A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二水合草酸亚铁(FeC2O42H2O)是制备某种铁锂电池最常用的原料。国内某科研团队以氮气为保护气,对二水合草酸亚铁的受热分解情况进行研究,生成的气体只含CO、CO2和H2O(g),得到固体质量与加热温度的变化曲线如图所示。下列说法正确的是
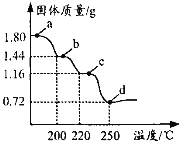
A.b点的固体成份为FeC2O4H2O
B.b→c 的方程式为 FeC2O4![]() FeCO3+CO↑
FeCO3+CO↑
C.从a→d, 生成的CO、CO2的物质的量相等
D.加热至250℃以上,固体质量略有增加,可能是因为FeO与CO反应生成了 Fe3C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据图中氮元素及其化合物的转化关系,判断下列说法不正确的是( )

A. X是N2O5
B. 可用排水法收集NO、NO2气体
C. 工业上以NH3、空气、水为原料生产硝酸
D. 由NH3→N2,从原理上看,NH3可与NO2反应实现
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com