
| 1000ρw |
| M |
| n |
| V |
| 1000ρw |
| M |
| 1000×1.84g/ml×98% |
| 98 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A | B | C | D |
| 0.1mol?L-1 CH3COOH溶液 | pH=12 NaOH溶液 | 0.1mol?L-1 NaOH溶液 | pH=2 CH3COOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
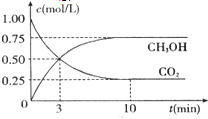 为减弱温室效应,除了减少CO2的排放、植树造林、将液态CO2注入深海等措施外,还有一种思路是将CO2转化成其它可燃物质.如工业上已实现CO2和H2反应生成甲醇的转化.已知:在一恒温、恒容密闭容器中充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0
为减弱温室效应,除了减少CO2的排放、植树造林、将液态CO2注入深海等措施外,还有一种思路是将CO2转化成其它可燃物质.如工业上已实现CO2和H2反应生成甲醇的转化.已知:在一恒温、恒容密闭容器中充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
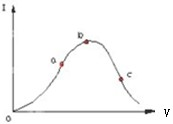 醋酸是一种弱电解质.在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:
醋酸是一种弱电解质.在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) |
| B、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) |
| C、10-3 mol?L-1的氨水与pH=3的硫酸等体积混合:c(SO42-)=c(NH4+)>c(OH-)=c(H+) |
| D、0.1mol?L-1CH3COOH溶液与0.1mol?L-1NaOH溶液等体积混合:c(Na+)=c(CH3COO-)+c(CH3COOH) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com