
����Ŀ����Ԫ�صĵ��ʼ��仯����������������Ӧ�ü���㷺�������������գ�
������������̽��
�����ͼʵ��װ�����Ʊ�����֤���������ʣ����ּг�װ��δ��������
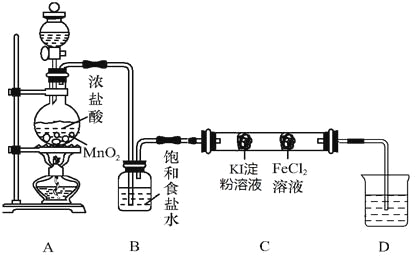
��1��A�з��ù���������̵�װ��������___________________��
��2��װ��B��������___________________��
��3��Ӳ�ʲ�����C������װ������մ������Լ���������������ʵ������Ϊ ��
��4��D�е�NaOH��Һ��������β������Ӧ���D�м�������ϡ�����������壬д���÷�Ӧ�����ӷ���ʽ ��
�����Ʊ�HClO
��5�����װ��E������ͼ��װ��C�������Ʊ��ϸ�Ũ�ȵ�HClO��Һ����Բ����ƿ�ײ�����һ����������ס�Ĺ�����״̼��ơ�
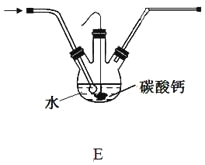
���÷��������Ƶýϸ�Ũ��HClO��ԭ���ǣ���ϱ�Ҫ�Ļ�ѧ���Իش� ��
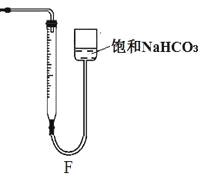
����Ӧ��������������ʣ���ʯ��ʯ���Һ�棬���õ���Һ��ϡ�����ϣ�������������CO2���壬��Ӧ������Һ�е����ʳ�HClO�⣬������ �� ��д���ָ��εĻ�ѧʽ��һ�����Σ�һ����ʽ�Σ�����С��ͬѧ��÷�Ӧ��̼�����������M g����Ӧ������õ�200mL��Һ��ȡ��10mL������ϡ�����ϣ�����Fװ�ò�ò������������ΪV L���ѻ���ɱ�״��������ԭ��Һ�к������ε�Ũ��Ϊ mol��L��1���ú�M��V�Ĵ���ʽ��ʾ����
���𰸡���1��Բ����ƿ��
��2����ȥCl2�е�HCl��
��3������ɫ��
��4��ClO-+Cl-+2H+=Cl2��+H2O��
��5����Cl2+H2O![]() H++Cl-+HClO��̼�����H+��Ӧ��ʹƽ�������ƶ���HClOŨ������
H++Cl-+HClO��̼�����H+��Ӧ��ʹƽ�������ƶ���HClOŨ������
��CaCl2Ca��HCO3��2M/20��V/0.448��
�����������������������װ�õ�Ŀ���ǽ����������ʵ�̽����AΪ�������Ʊ�װ�ã�BΪ�����ľ���װ�ã�CΪ����̽����װ�ã�DΪβ������װ�á���1��A�з��ù���������̵�װ����Բ����ƿ����2��װ��B�������dz�ȥ�����л��е�HCl���ʡ���3��Ӳ�ʲ�����C��������KI����ΪI2�������۱���ɫ����4��D�е�NaOH��Һ��������β������Ӧ�����Һ�к����Ȼ��ƺʹ������ƣ���������ϡ����ᷢ�����з�Ӧ������������Ӧ�����ӷ���ʽΪClO-+Cl-+2H+= Cl2��+H2O��
������5����������ˮ�д����ܽ�ƽ��Cl2+ H2O![]() H+ + Cl- + HClO�����Ʊ�HClOʱ������̼�������H+��Ӧ��ʹƽ�������ƶ���HClOŨ����������ԭ��ˮ�д���HCl��HClO��HCl��̼��Ʒ�Ӧ����CaCl2�����õ���Һ��ϡ�����ϣ�������������CO2���壬˵����Һ�к�����Ca��HCO3��2����Ӧ��̼�����������M g�����ʵ���Ϊ
H+ + Cl- + HClO�����Ʊ�HClOʱ������̼�������H+��Ӧ��ʹƽ�������ƶ���HClOŨ����������ԭ��ˮ�д���HCl��HClO��HCl��̼��Ʒ�Ӧ����CaCl2�����õ���Һ��ϡ�����ϣ�������������CO2���壬˵����Һ�к�����Ca��HCO3��2����Ӧ��̼�����������M g�����ʵ���Ϊ![]() mol������ݸ�Ԫ���غ㣬���ɵ�CaCl2��Ca��HCO3��2�������ʵ���Ϊ
mol������ݸ�Ԫ���غ㣬���ɵ�CaCl2��Ca��HCO3��2�������ʵ���Ϊ![]() mol����Ӧ������õ�200mL��Һ��ȡ��10mL������ϡ�����ϣ�Fװ�ò�ò�����CO2���ΪV L�����ʵ���Ϊ
mol����Ӧ������õ�200mL��Һ��ȡ��10mL������ϡ�����ϣ�Fװ�ò�ò�����CO2���ΪV L�����ʵ���Ϊ![]() mol����200mL��Һ��Ca��HCO3��2�����ʵ���Ϊ
mol����200mL��Һ��Ca��HCO3��2�����ʵ���Ϊ![]() ��20��
��20��![]() =
=![]() mol������CaCl2�����ʵ���Ϊ��
mol������CaCl2�����ʵ���Ϊ��![]() ��
��![]() ��mol����ԭ200mL��Һ�к������ε�Ũ��Ϊ��
��mol����ԭ200mL��Һ�к������ε�Ũ��Ϊ��![]() ��
��![]() ��mol��L��1��
��mol��L��1��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��֪2KMnO4+16HCl(Ũ)=2KCl+2MnCl2+8H2O+5Cl2��
��1��������Ӧ�б�������Ԫ����_______;��ԭ������_____________
��2���������뻹ԭ�������ʵ���֮����________________________
��3��������Ӧ��KMnO4��HCl(Ũ)��MnCl2�� Cl2��������������ǿ������˳��Ϊ��_________________________________________
��4�������÷�Ӧ����ת�Ʒ������Ŀ��_______________________________________
��.��1��V L Fe2��SO4��3��Һ�к�Fe3+ a g�������Һ��Fe3+�����ʵ���Ũ��Ϊ____molL��1�����ʵ����ʵ���Ũ��Ϊ______ molL��1��
��2��12.4g Na2X����0.4mol Na+,�����ʵĻ�ѧʽ__________.
��3��Ϊ�˹�ѧ��������Ҫ���SO42-��CO32-��H+��OH-��NH4+��Fe3+��Na+�������Ӹ��ݹ���ԭ����Ϊ��������Һ�������������ĿҪ�ӽ����������ǣ�
��һ�飺____________________���ڶ��飺____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�ҹ۲�������������ץȡ��һ����̼���Ӻ���ԭ��������ɶ�����̼���ӵĹ��̡����й���̼���������˵����ȷ����
A. CO��CO2��Ϊ���������� B. CO��ú������Ҫ�ɷ�֮һ
C. CO2��������� D. ����CO2���ŷſɵ���������γ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ϩ������ͬ��̼����ٷֺ��������Ȳ���ͬϵ���ֲ���ͬ���칹�����( )
A.������B.������C.��ϩD.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
A.ţ���Ǵ������Һ̬
B.ţ���Ǹ�֬�������Ҵ����ɵ���
C.ţ�Ϳ����ڼ��������¼���ˮ��
D.ţ�Ͳ��������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ�����м׳ص��ܷ�ӦʽΪ��2CH3OH��3O2��4KOH![]() 2K2CO3��6H2O������˵������ȷ����
2K2CO3��6H2O������˵������ȷ����

A���׳�ͨ��CH3OH�ĵ缫��ӦΪCH3OH6e��2H2O![]()
![]() ��8H+
��8H+
B���׳�������280 mL(��״����)O2����ʱ������������������1.45 g����
C����Ӧһ��ʱ������ҳ��м���һ����CuCO3���壬��ʹCuSO4��Һ�ָ�ԭŨ��
D���׳��ǻ�ѧ��ת��Ϊ���ܵ�װ�ã��ҡ������ǵ���ת��Ϊ��ѧ�ܵ�װ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]̼���仯����㷺��������Ȼ���У��ش��������⣺
��1������һ���ռ��˶�״̬�ĵ�����ԭ�Ӻ�����ֵĸ����ܶȷֲ����� �����������ڻ�̬ԭ���У�������� �������෴�ĵ��ӡ�
��2��̼���γɻ�����ʱ��������Թ��ۼ�Ϊ����ԭ���� ��
��3��CS2�����У����ۼ��������� ��Cԭ�ӵ��ӻ���������� ��д��������CS2������ͬ�ռ乹�ͺͼ�����ʽ�ķ��ӻ����� ��
��4��CO�������Fe�γ�Fe(CO)5���û�������۵�Ϊ253K���е�Ϊ376K����������� ���塣
̼�ж���ͬ�������壬����ʯīϩ����ʯ�ľ���ṹ��ͼ��ʾ��

����ʯīϩ�����У�ÿ��Cԭ������ ����Ԫ����ÿ����Ԫ��ռ�� ��Cԭ�ӡ�
���ڽ��ʯ�����У�Cԭ�������ӵ���С��ҲΪ��Ԫ����ÿ��Cԭ������ ����Ԫ������Ԫ��������� ��Cԭ����ͬһƽ�档
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ̽��ͭ��ϡ���ᷴӦ�IJ��PӰ�췴Ӧ���ʵ���Ҫ���أ���������ʵ�顣
ʵ��һ ̽��ͭ��ϡ���ᷴӦ�IJ���ʵ��װ����ͼ��ʾ���������Ѽ�顣

��֪��FeSO4��NO===[Fe(NO)]SO4���÷�Ӧ�ϻ�����������һ����[Fe(NO)]2��ʱͻ������
��ɫ��
(1)ʵ�鿪ʼʱ�Ƚ�Y���Թ���ʢ��̼��Ƶ�֧����б����������ϡ���ᣬ��ʵ�������Ŀ����___________________________________________________________��
(2)ͭƬ��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ____________________________________��
(3)��ʵ��A���ɵ������У�����NO2����B��ʵ������Ϊ__________________��
��ֻ��NO���ɣ���B��ʵ��������_________________��
ʵ��� ̽����ѧ��Ӧ����Է�Ӧ���ʵ�Ӱ��
�������ʵ�飬������ͼװ�òⶨ��Һͻ��������ɫ��ʱ�䡣
��� | �¶� | ͭƬ/(g) | ����/mL | ����ͭ/g |
1 | 25 �� | �� | �� | �� |
2 | 25 �� | 5 | 20 | 0.5 |
3 | 25 �� | 5 | 20 | 1.0 |
(4)�뽫�ϱ���ʵ��1��ʵ��������д������
��________����________����________��
(5)ͨ��ʵ�鷢��ʵ��1��2��3�ķ�Ӧ���ʲ������Ա仯��Ϊ�ﵽʵ��Ŀ�Ļ���Ҫ�������е�ʵ����_______________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��![]() �����Ҫ�ϳ�
�����Ҫ�ϳ� ![]() �����õ�ԭʼԭ�Ͽ����ǣ� ��
�����õ�ԭʼԭ�Ͽ����ǣ� ��
A. 2 -��-l��3 -����ϩ��1 -��Ȳ B. l��3 �C���ϩ��2 -��Ȳ
C. 2��3 -����-1��3 -���ϩ����Ȳ D. 2��3 -����-l��3 -����ϩ�ͱ�Ȳ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com