
【题目】向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
(1)Cu与稀HNO3反应的离子方程式为__。
(2)Cu与Cu2O 的物质的量之比为__。
(3)HNO3的物质的量浓度为__mol·L-1。
【答案】3Cu+8H++![]() =3Cu2++2NO↑+4H2O 2∶1 2.4
=3Cu2++2NO↑+4H2O 2∶1 2.4
【解析】
Cu和Cu2O与稀硝酸反应生成硝酸铜,0.2molCu完全反应失去0.4mol电子,0.1molCu2O完全反应失去0.2mol电子,总共生成0.6mol电子,由电子守恒,生成NO的物质的量为![]() =0.2mol,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性,金属离子恰好完全沉淀,反应后的溶质为硝酸钠,则溶液中的硝酸根离子的物质的量为n(NO3-)=n(NaOH)=1mol/L×1L=1mol,则硝酸的总物质的量为1mol+0.2mol=1.2mol,根据c=
=0.2mol,在所得溶液中加入1.0mol/L的NaOH溶液1.0L,此时溶液呈中性,金属离子恰好完全沉淀,反应后的溶质为硝酸钠,则溶液中的硝酸根离子的物质的量为n(NO3-)=n(NaOH)=1mol/L×1L=1mol,则硝酸的总物质的量为1mol+0.2mol=1.2mol,根据c=![]() 进行计算。
进行计算。
①Cu与稀HNO3反应生成硝酸铜、一氧化氮和水,离子反应方程式:3Cu+8H++![]() =3Cu2++2NO↑+4H2O;
=3Cu2++2NO↑+4H2O;
②所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子已完全沉淀,溶液中溶质为NaNO3,n(NaNO3)=n(NaOH)=1.0 mol·L-1×1.0 L=1 mol,沉淀为Cu(OH)2,质量为39.2 g,物质的量为![]() =0.4 mol,根据铜元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],所以反应后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.4 mol,设Cu、Cu2O的物质的量分别为x、y,则
=0.4 mol,根据铜元素守恒有n(Cu)+2n(Cu2O)=n[Cu(OH)2],所以反应后的溶液中n[[Cu(NO3)2]=n[Cu(OH)2]=0.4 mol,设Cu、Cu2O的物质的量分别为x、y,则
![]()
解得x=0.2,y=0.1,所以Cu与Cu2O 的物质的量之比为2∶1;
③Cu和Cu2O与稀硝酸反应生成硝酸铜,0.2 mol Cu完全反应失去0.4 mol电子,0.1 mol Cu2O完全反应失去0.2 mol电子,总共失去0.6 mol电子,由电子守恒,生成NO的物质的量为![]() =0.2 mol,在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子恰好完全沉淀,反应后的溶质为硝酸钠,则溶液中的硝酸根离子的物质的量为n(
=0.2 mol,在所得溶液中加入1.0 mol·L-1的NaOH溶液1.0 L,此时溶液呈中性,金属离子恰好完全沉淀,反应后的溶质为硝酸钠,则溶液中的硝酸根离子的物质的量为n(![]() )=n(NaOH)=1 mol·L-1×1 L=1 mol,则硝酸的总物质的量为1 mol+0.2 mol=1.2 mol,硝酸的浓度为
)=n(NaOH)=1 mol·L-1×1 L=1 mol,则硝酸的总物质的量为1 mol+0.2 mol=1.2 mol,硝酸的浓度为![]() =2.4 mol·L-1。
=2.4 mol·L-1。


科目:高中化学 来源: 题型:
【题目】化学与生活、生产、科技关系密切,下列说法中正确的是( )
A.“碳海绵”吸收泄漏的原油时发生了化学变化
B.“玉兔二号”月球车首次实现在月球背面着陆,其帆板太阳能电池的材料是二氧化硅
C.“嫘祖栽桑蚕吐丝,抽丝织作绣神奇”中的“丝”不耐酸碱
D.氢燃料电池中使用的储氢材料,如稀土类![]() 等合金材料是纯净物
等合金材料是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废铅蓄电池的回收中产生大量的铅膏,回收利用铅膏能有效减少铅污染,充分利用铅资源。
(1)铅膏制备PbO。铅膏经过预处理后(主要成分为PbSO4)加入Na2CO3溶液,使之转化为PbCO3,然后充分灼烧得到PbO。
①PbCO3分解产生aPbCO3bPbO中间产物。PbCO3和PbSO4加热升温过程中固体的质量变化见图1。PbCO3在300 ℃时分解的产物为_____________。
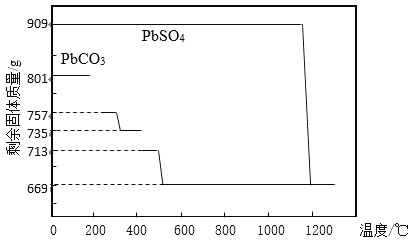
②工业上用PbCO3热分解制备的PbO而不直接热分解PbSO4制备的PbO的原因是_____________。
(2)沉淀除铅。铅膏经过转化后得到含铅的Na2SO4废液,需要进一步除去废水中的铅。
①常温下,该废液中![]() 浓度为0.01 mol·L1,则该废液中Pb2+浓度最大为_____________。[Ksp(PbSO4)=1.8×108]
浓度为0.01 mol·L1,则该废液中Pb2+浓度最大为_____________。[Ksp(PbSO4)=1.8×108]
②随温度升高和![]() 浓度增大废液中Pb2+浓度显著增大,所以工业通常采用向废液中加入Na2CO3、NaHCO3或NaOH等碱性沉淀剂产生Pb(OH)2沉淀除铅。废液随着pH的变化生成Pb(OH)2的质量如图2。向含铅废液中投放NaHCO3发生的离子方程式为_____________。在实际生产中采用NaHCO3或Na2CO3沉铅,不采用NaOH的原因是_____________。
浓度增大废液中Pb2+浓度显著增大,所以工业通常采用向废液中加入Na2CO3、NaHCO3或NaOH等碱性沉淀剂产生Pb(OH)2沉淀除铅。废液随着pH的变化生成Pb(OH)2的质量如图2。向含铅废液中投放NaHCO3发生的离子方程式为_____________。在实际生产中采用NaHCO3或Na2CO3沉铅,不采用NaOH的原因是_____________。
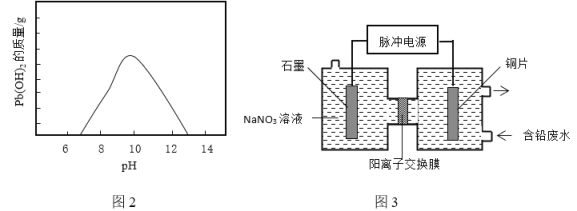
(3)电化学除铅。利用脉冲电源(间歇性通入电流)电解法转化废液中的Pb2+实现铅资源化利用,可以提高除铅效率(除铅效率与Pb2+浓度有关),其原理示意图3。
①写出阳极的电极反应式:__________。
②采用脉冲电解比普通电源电解的优点是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中,一定条件下发生反应:2A(?) ![]() B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
B(g)+2C(g),且达到平衡。当升高温度时气体的密度增大,则下列叙述中正确的是 ( )
A.升高温度,正反应速率增大,逆反应速率减小B.若正反应是放热反应,则A为气态
C.物质A一定为非气态,且正反应是吸热反应D.若向容器中充入惰性气体,则平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HIn在水溶液中存在以下电离平衡:HIn(红色)![]() H+ + In-(黄色),故可用作酸碱指示剂。浓度为0.02 mol/L的下列各溶液:①盐酸,②石灰水,③NaCl溶液,④NaHSO4溶液,⑤Na2CO3溶液,⑥氨水,其中能使指示剂显红色的是
H+ + In-(黄色),故可用作酸碱指示剂。浓度为0.02 mol/L的下列各溶液:①盐酸,②石灰水,③NaCl溶液,④NaHSO4溶液,⑤Na2CO3溶液,⑥氨水,其中能使指示剂显红色的是
A. ①④⑤ B. ②⑤⑥ C. ①④ D. ②③⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃,101 k Pa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3 kJ/mol,辛烷的燃烧热为5518 kJ/mol。下列热化学方程式书写正确的是( )
A. 2H+(aq) +![]() (aq)+
(aq)+![]() (aq)+2OH
(aq)+2OH![]() (aq)=BaSO4(s)+2H
(aq)=BaSO4(s)+2H![]() O(l);
O(l);![]() H=
H=![]() 57.3 kJ/mol
57.3 kJ/mol
B. KOH(aq)+![]() H
H![]() SO4(aq)=
SO4(aq)=![]() K
K![]() SO4(aq)+H
SO4(aq)+H![]() O(l);
O(l);![]() H=
H=![]() 57.3kJ/mol
57.3kJ/mol
C. C8H18(l)+![]() O
O![]() (g)=8CO
(g)=8CO![]() (g)+ 9H
(g)+ 9H![]() O;
O;![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
D. 2C8H18(g)+25O![]() (g)=16CO
(g)=16CO![]() (g)+18H
(g)+18H![]() O(l);
O(l);![]() H=
H=![]() 5518 kJ/mol
5518 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为证明乙烯能被酸性KMnO4溶液氧化,某小组按下图装置制备乙烯并检验其化学性质。完成下列填空:
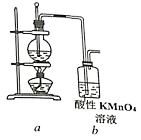
(1)首先检验该装置气密性。检验气密性的操作是:_____________。
(2)向圆底烧瓶中加入药品的顺序是:先加入_____,再缓慢加入____,最后再加入几粒碎瓷片。
(3)加热圆底烧瓶,使温度迅速上升到________℃,观察到烧瓶中的无色液体逐渐变黑。该黑色的物质是_______。
(4)酸性KMnO4溶液很快褪色,但不能说明乙烯具有还原性。理由是:_______________。
(5)选用下列装置(可重复使用也可不用)来证明乙烯具有还原性,请将装置按编号依次排列,并在装置序号对应位置的下一行写出装置内所放的药品。
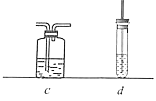
装置a→_____________________________→b。
药品:(a药品略)_________________________(b酸性KMnO4溶液)。
(6)若将b中酸性KMnO4溶液换成溴水,溴水也能褪色且可观察到b底部有少量无色油状液体生成,如何通过实验证明该无色油状液体中含有溴元素?______。如何通过实验证明乙烯和溴水发生的是加成反应而不是取代反应?____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CrCl3·6H2O是中学化学中的常见物质,工业上用铬酸钠(Na2CrO4)来制备。某兴趣小组以实验室中的红矾钠(Na2Cr2O7)为原料来制备CrCl3·6H2O。流程如下:

已知:
a.CrCl3·6H2O不溶于乙醚,易溶于水、乙醇、易水解。
b.CrCl3·6H2O易升华,在高温下能被氧化。
(1)步骤Ⅰ中加入40%NaOH的目的是__________________________。步骤1中甲醇作为还原剂,反应后生成CO2,请写出反应的离子方程式_________________________。
(2)步骤Ⅲ,请补充完整由步骤Ⅱ得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:
ⅰ:将过滤后所得固体溶解于过量的盐酸中,ⅱ: ,ⅲ:过滤,ⅳ:洗涤,ⅴ:干燥,得到CrCl3·6H2O。
①操作ⅱ为_________________________________。
②操作ⅳ最合适的洗涤剂是_____________。
A.乙醇 B.乙醚 C.冷水
③操作ⅴ应选择的干燥方式为_____________。
(3)样品中三氯化铬质量分数的测定
称取样品,加水溶解并定容于容量瓶中。移取一定体积溶液于碘量瓶(一种带塞的锥形瓶)中,加入Na2O2,在一定条件下充分反应后,适当稀释,然后加入过量的稀H2SO4至溶液呈强酸性,此时铬以![]() 存在。充分加热煮沸后,加入KI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用硫代硫酸钠溶液滴定至终点。
存在。充分加热煮沸后,加入KI,密塞,摇匀,于暗处静置5分钟后,加入1mL指示剂,用硫代硫酸钠溶液滴定至终点。
①充分加热煮沸的原因是 _______________________。
②在使用硫代硫酸钠溶液滴定过程中使用到碱式滴定管,选出其正确操作并按顺序列出字母:蒸馏水洗涤→加入待量液3~5mL→_____→_____→_____→_____→_____→滴定,进行实验。
a.加液至“0”刻度以上2~3cm
b.倾斜转动滴定管,使液体润湿滴定管内壁,挤压玻璃球,放液
c.调整至“0”或“0”刻度以下,静止1min,读数
d.将滴定管尖端插入锥形瓶内约1cm
e.将滴定管尖端对准锥形瓶,且置于锥形瓶口上方约1cm处
f.右手拿住滴定管使它倾斜30°,左手迅速打开活塞
g.橡皮管向上弯曲,挤压玻璃球,放液
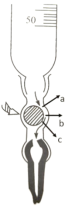
③下图是碱式滴定管的内部构造,滴定时,左手应该捏住乳胶管中玻璃球的______部位(填“a”、“b”或“c”),挤捏乳胶管,使其与玻璃球之间形成一条缝隙,溶液即可流出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼是一种奇特的元素,它来自超新星爆发和宇宙射线的散列辐射。
(1)写出BF3电子式___________,B与F形成共价键时,共用电子对偏向_____原子,判断依据是_________________。
(2)硼酸(H3BO3)在水中电离出阴离子[B(OH)4]-,请写出硼酸的电离方程式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com