
【题目】硼是一种奇特的元素,它来自超新星爆发和宇宙射线的散列辐射。
(1)写出BF3电子式___________,B与F形成共价键时,共用电子对偏向_____原子,判断依据是_________________。
(2)硼酸(H3BO3)在水中电离出阴离子[B(OH)4]-,请写出硼酸的电离方程式___________。
【答案】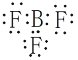 氟 B与F同周期,核电荷数F>B,原子半径B>F,非金属性F>B B(OH)3+H2O
氟 B与F同周期,核电荷数F>B,原子半径B>F,非金属性F>B B(OH)3+H2O![]() [B(OH)4]-+ H+
[B(OH)4]-+ H+
【解析】
(1)BF3中每个氟原子与硼原子形成一对共用电子对;由不同种非金属元素形成的共价键为极性共价键,共用电子对偏向于吸引电子能力强的元素,非金属性越强,吸引电子能力越强,据此分析解答;
(2)硼酸(H3BO3)能电离,它在水中能结合水电离出的OH-,形成[B(OH)4]-离子,结合水的电离可知硼酸还应该电离出氢离子,据此写出硼酸的电离方程式。
(1)BF3中每个氟原子与硼原子形成一对共用电子对,则电子式为 ;由不同种非金属元素形成的共价键为极性共价键,共用电子对偏向于吸引电子能力强的元素,非金属性越强,吸引电子能力越强,B与F同周期,核电荷数F>B,原子半径B>F,非金属性F>B,则共用电子对偏向于氟原子;
;由不同种非金属元素形成的共价键为极性共价键,共用电子对偏向于吸引电子能力强的元素,非金属性越强,吸引电子能力越强,B与F同周期,核电荷数F>B,原子半径B>F,非金属性F>B,则共用电子对偏向于氟原子;
(2)硼酸(H3BO3)能电离,它在水中能结合水电离出的OH,形成[B(OH)4]-离子,则硼酸还电离出氢离子,则其电离方程式为:B(OH)3+H2O![]() [B(OH)4]-+ H+。
[B(OH)4]-+ H+。


科目:高中化学 来源: 题型:
【题目】向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
(1)Cu与稀HNO3反应的离子方程式为__。
(2)Cu与Cu2O 的物质的量之比为__。
(3)HNO3的物质的量浓度为__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时的反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是:Fe(OH)2+2e-===Fe+2OH-
③充电时,Ni(OH)2为阳极
④该蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中A~L分别代表中学化学中的常见物质(部分反应的条件已略去)。A是一种常见氮肥,摩尔质量为79 g·mol-1。常温下,C是无色液体,E、L为常见金属单质,B、G、I、J、K为气体,其中D能使澄清的石灰水变浑浊,K呈红棕色。F为有磁性的黑色固体。
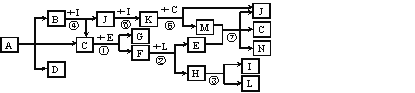
(1)A的化学式为____。
(2)写出反应④的化学方程式:____。
(3)写出反应①的化学方程式:____。
(4)若反应⑦中物质E过量,写出该反应的离子方程式:____。
(5)气体B或K直接排放到空气中会污染环境,在催化剂作用下两者会反应生成对环境无害的物质。写出该反应的方程式,并用单线桥表示电子转移的方向和数目:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
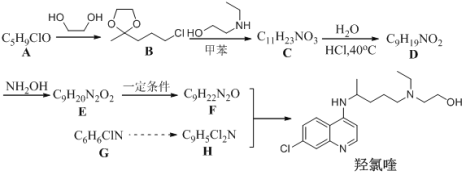
【题目】羟氯喹是一种抗疟药物,被WHO支持用于新冠肺炎患者临床研究。某研究小组设计如下合成路线:
已知:
①
② ![]()
③
④苯环上连卤原子时,发生再取代反应主要生成邻、对位产物。
按要求回答下列问题:
(1)化合物A所含官能团的名称为___________________,化合物C的结构简式_______。
(2)下列说法正确的是___________________。
A. A到D过程中,乙二醇的作用是作为保护基团
B. 从合成路线推测,化合物B要密封干燥保存
C. E→F为加成反应
D. 羟氯喹的分子式为C18H26ClN3O
(3)D→E的化学方程式为____________________________。
(4)设计以苯为原料合成化合物G(用流程图表示,无机试剂任选)______________。
(5)写出同时符合下列条件的H的同分异构体的结构简式(不考虑立体异构):_______________。
1H-NMR和IR谱检测表明:
①苯环上有两种环境的不同氢,且两种氢的比例为2:1;②分子中含有氰基(-CN)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素A、B、C、D、E的原子序数依次增大,A和C同族,B和D同族,C离子和B离子具有相同的电子层结构。A和B、D、E均能形成共价型化合物。A和B形成的化合物在水中呈碱性,C和E形成的化合物是日常生活中的常用调味品。回答下列问题:
(1)五种元素中,原子半径最大的是________,非金属性最强的是________(填元素符号)。
(2)由A分别和B、D、E所形成的共价型化合物中,热稳定性最差的是__________(用化学式表示)。
(3)A、B、E形成的离子化合物电子式为____________,其中存在的化学键类型为____________。
(4)D最高价氧化物的水化物的化学式为________________。
(5)单质D在充足的单质E中燃烧,反应的化学方程式为__________________;D在不充足的E中燃烧,生成的主要产物的化学式为__________。
(6)单质E与水反应的离子方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.使用催化剂能够降低化学反应的反应热△H
B.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)的ΔH=+2×283.0kJ/mol
C.需要加热才能发生的反应一定是吸热反应
D.HCl和NaOH反应的中和热ΔH=-57.3kJ/mol,则H2SO4和NH3.H2O反应的中和热ΔH=2(-57.3)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向2 L的密闭容器中充入一定量的A和B,发生反应:A(g)+B(g) ![]() C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( )
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量随时间的变化如图所示。下列说法正确的是( )
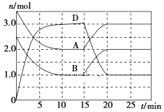
A.反应在前10 min内的平均反应速率v(D)=0.3mol·L-1·min-1
B.若平衡时保持温度不变,压缩容器体积,平衡向逆反应方向移动,平衡常数K值减小
C.反应至15min时,其他条件不变,改变的条件可能是缩小容器体积
D.反应至15min时,其他条件不变,改变的条件可能是降低反应体系温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)因其硬度大、熔点高、常温时耐酸碱腐蚀而被广泛用作高新科技材料,被誉为“未来金属”。以钛铁矿(主要成分钛酸亚铁)为主要原料冶炼金属钛同时获得副产品甲的工业生产流程如下。请回答下列问题。
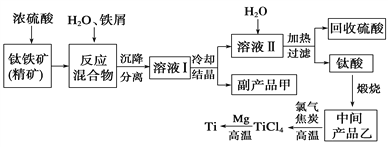
(1)钛酸亚铁(用R表示)与碳在高温下反应的化学方程式为2R+C═2Fe+2TiO2+CO2↑,钛酸亚铁的化学式为_______________;钛酸亚铁和浓H2SO4反应的产物之一是TiOSO4,反应中无气体生成,该反应的化学方程式为____________________。
(2)上述生产流程中加入铁屑的目的是_________________________,此时溶液Ⅰ中含有Fe2+、TiO2+和少量Mg2+等阳离子。常温下,其对应氢氧化物的Ksp如下表所示。
氢氧化物 | Fe(OH)2 | TiO(OH)2 | Mg(OH)2 |
Ksp | 8.0×10-16 | 1.0×10-29 | 1.8×10-11 |
①常温下,若所得溶液中Mg2+的物质的量浓度为0.0018mol/L,当溶液的pH等于_______时,Mg(OH)2开始沉淀。
②若将含有Fe2+、TiO2+和Mg2+的溶液加水稀释,立即析出大量白色沉淀,该反应的离子方程式为___________________________________________________________。
(3)中间产品乙与焦炭、氯气在高温下发生反应制取TiCl4的方程式为________。Mg还原TiCl4过程中必须在1070K的温度下进行,你认为还应该控制的反应条件是_________。除去所得金属钛中少量的金属镁可用的试剂是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com