
【题目】废铅蓄电池的回收中产生大量的铅膏,回收利用铅膏能有效减少铅污染,充分利用铅资源。
(1)铅膏制备PbO。铅膏经过预处理后(主要成分为PbSO4)加入Na2CO3溶液,使之转化为PbCO3,然后充分灼烧得到PbO。
①PbCO3分解产生aPbCO3bPbO中间产物。PbCO3和PbSO4加热升温过程中固体的质量变化见图1。PbCO3在300 ℃时分解的产物为_____________。
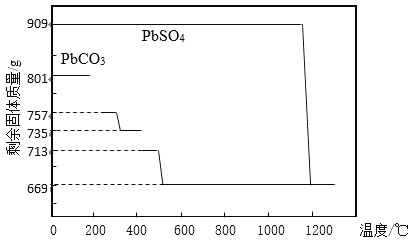
②工业上用PbCO3热分解制备的PbO而不直接热分解PbSO4制备的PbO的原因是_____________。
(2)沉淀除铅。铅膏经过转化后得到含铅的Na2SO4废液,需要进一步除去废水中的铅。
①常温下,该废液中![]() 浓度为0.01 mol·L1,则该废液中Pb2+浓度最大为_____________。[Ksp(PbSO4)=1.8×108]
浓度为0.01 mol·L1,则该废液中Pb2+浓度最大为_____________。[Ksp(PbSO4)=1.8×108]
②随温度升高和![]() 浓度增大废液中Pb2+浓度显著增大,所以工业通常采用向废液中加入Na2CO3、NaHCO3或NaOH等碱性沉淀剂产生Pb(OH)2沉淀除铅。废液随着pH的变化生成Pb(OH)2的质量如图2。向含铅废液中投放NaHCO3发生的离子方程式为_____________。在实际生产中采用NaHCO3或Na2CO3沉铅,不采用NaOH的原因是_____________。
浓度增大废液中Pb2+浓度显著增大,所以工业通常采用向废液中加入Na2CO3、NaHCO3或NaOH等碱性沉淀剂产生Pb(OH)2沉淀除铅。废液随着pH的变化生成Pb(OH)2的质量如图2。向含铅废液中投放NaHCO3发生的离子方程式为_____________。在实际生产中采用NaHCO3或Na2CO3沉铅,不采用NaOH的原因是_____________。
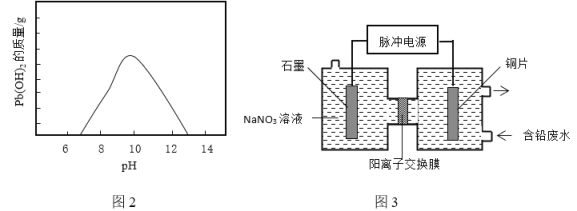
(3)电化学除铅。利用脉冲电源(间歇性通入电流)电解法转化废液中的Pb2+实现铅资源化利用,可以提高除铅效率(除铅效率与Pb2+浓度有关),其原理示意图3。
①写出阳极的电极反应式:__________。
②采用脉冲电解比普通电源电解的优点是__________。
【答案】PbCO3PbO 因为PbSO4分解温度高,消耗能量多,产生硫的氧化物,污染大 1.8×10-6mol/L Pb2++2HCO3-=Pb(OH)2↓+2CO2↑ NaOH的碱性强,容易与Pb(OH)2反应而使其溶解,而使用NaHCO3或Na2CO3溶液,碱性弱,容易控制pH,从而最大限度的使铅沉淀。 4OH--4e-=O2↑+2H2O 可以让阴、阳离子充分的移动到阳极和阴极附近,电极区相关离子浓度更大,有利于电解。
【解析】
由图1,根据固体质量的变化值,可求出分解产物;由图1,根据PbCO3和PbSO4分解完全,温度不同,产物不同来解答;根据Ksp可计算Pb2+浓度;根据图2,可判断采用NaHCO3或Na2CO3沉铅,不采用NaOH的理由;根据图3可判断电解池的阴阳极,据此解答。
(1)①如图所示,m(PbCO3)=801g,300℃时剩余固体质量m=735g,△m=801g-735g=66g,根据(a+b)PbCO3![]() aPbCO3bPbO+bCO2,得出
aPbCO3bPbO+bCO2,得出 ,267(a+b)×66=801×44b,解之,a=b,化学方程式为2PbCO3
,267(a+b)×66=801×44b,解之,a=b,化学方程式为2PbCO3![]() PbCO3PbO+CO2,产物为PbCO3PbO;答案为PbCO3PbO。
PbCO3PbO+CO2,产物为PbCO3PbO;答案为PbCO3PbO。
②由图1可知,PbCO3分解完全只需500℃,产物为PbO和CO2,PbSO4分解完全需要1200℃,且产生硫的氧化物,因而PbSO4分解温度高,消耗能量多,产生硫的氧化物,污染大;答案为因为PbSO4分解温度高,消耗能量多,产生硫的氧化物,污染大。
(2)①因为Ksp(PbSO4)=1.8×10-8,Ksp(PbSO4)=c(Pb2+)×c(SO42-),已知c(SO42-)=0.01mol/L,则c(Pb2+)=![]() =
= ![]() =1.8×10-6mol/L;答案为1.8×10-6mol/L。
=1.8×10-6mol/L;答案为1.8×10-6mol/L。
②向含铅废液中投放NaHCO3,则HCO3-与Pb2+反应,生成Pb(OH)2沉淀,根据原子守恒,可判断还有CO2产生,则离子方程式为Pb2++2HCO3-=Pb(OH)2↓+2CO2↑,由图2可知,pH=10时,Pb(OH)2沉淀量最大,如果使用NaOH,它的碱性强,容易超过pH=10,而使Pb(OH)2溶解,使用NaHCO3或Na2CO3溶液,碱性弱,容易控制pH,从而最大限度地使铅沉淀;答案为Pb2++2HCO3-=Pb(OH)2↓+2CO2↑,NaOH的碱性强,容易与Pb(OH)2反应而使其溶解,而使用NaHCO3或Na2CO3溶液,碱性弱,容易控制pH,从而最大限度地使铅沉淀。
(3)①根据图3,是一个电解池,阳极应该是石墨,如果是铜,会牺牲阳极,阳极区电解液是NaNO3,根据OH-的放电能力大于NO3-,所以阳极的电极反应为4OH--4e-=O2↑+2H2O,答案为4OH--4e-=O2↑+2H2O。
②因为在电解过程中,离子浓度会迅速降低,采用脉冲电解,在断电间隙时间内,可以让阴、阳离子充分的移动到阳极和阴极附近,离子浓度又会得到迅速恢复和补充,电极区相关离子浓度更大,有利于电解;答案为可以让阴、阳离子充分的移动到阳极和阴极附近,电极区相关离子浓度更大,有利于电解。


 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】关于如图的说法不正确的是( )

A. 1mol固态碘与![]() 化合生成2molHI气体时,需要吸收5kJ的能量
化合生成2molHI气体时,需要吸收5kJ的能量
B. 2molHI气体分解生成1mol碘蒸气与![]() 时需要吸收12kJ的能量
时需要吸收12kJ的能量
C. 1mol固态碘变为1mol碘蒸气时需要吸收17kJ的能量
D. 碘蒸气与![]() 生成HI气体的反应是吸热反应
生成HI气体的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验过程中,下列溶液的导电能力变化不大的是
A. ![]() 溶液中滴入
溶液中滴入![]() 溶液至过量
溶液至过量
B. 醋酸溶液中滴入氨水至过量
C. 澄清石灰水中通入![]() 至过量
至过量
D. ![]() 溶液中加入适量的NaOH固体
溶液中加入适量的NaOH固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka1 (H2SO3)=1.5×10-2,Ka2=1.0×10-7,Kb (NH3·H2O) =1.76×10-5,设H2SO3溶液中c(总)=c(![]() )+c(
)+c(![]() )+c(H2SO3)。室温下将氨气通入25.00 mL 0.1000 mol·L1H2SO3溶液中(忽略溶液体积变化),下列说法正确的是
)+c(H2SO3)。室温下将氨气通入25.00 mL 0.1000 mol·L1H2SO3溶液中(忽略溶液体积变化),下列说法正确的是
A.溶液中始终存在:c(![]() )+c(H+ )=c(
)+c(H+ )=c(![]() )+c(
)+c(![]() )+c(OH)
)+c(OH)
B.在NH4HSO3溶液中:c(![]() )>c(
)>c(![]() )>c(NH3·H2O)>c(H2SO3)
)>c(NH3·H2O)>c(H2SO3)
C.pH=7的溶液:c(![]() )=2c(
)=2c(![]() )+c(
)+c(![]() )
)
D.c(![]() )=2c(总)的溶液中:c(NH3·H2O)+c(OH)=c(H+ )+c(
)=2c(总)的溶液中:c(NH3·H2O)+c(OH)=c(H+ )+c(![]() )+2c(H2SO3)
)+2c(H2SO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁铵(NH4)2SO4·FeSO4·6H2O为浅绿色晶体,实验室中以废铁屑为原料来制备,步骤如下:
步骤1:将铁屑放入与铁不反应的洗涤剂去除铁表面的油污,分离出液体,洗净铁屑
步骤2:向处理过的铁屑中加入过量的稀硫酸 溶液,在60℃左右使其反应到不再产生气体,趁热过滤,得FeSO4溶液。
步骤3:向所得FeSO4溶液中加入饱和(NH4)2SO4溶液,经过“一系列操作”后得到硫酸亚铁铵晶体。
请回答下列问题:
(1)在步骤1中的分离操作,所用到的玻璃仪器有____________________。(填仪器编号)
①漏斗 ②分液漏斗 ③烧杯 ④广口瓶 ⑤铁架台 ⑥玻璃棒 ⑦酒精灯
(2)为确认晶体中Fe2+在制备过程中没有被氧化,请你设计简单的实验方案进行验证(写出简单的实验过程、实验现象及结论)_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时,A的溶解度是Sg·100g-1,其饱和溶液密度为dg·cm-3、物质的量浓度为cmol·L-1。溶液的质量分数为w,A的摩尔质量为Mg·mol-1,实验测得向一定量含A的溶液中加入mg无水A或蒸发掉ng水后恢复到t℃,均为饱和溶液,下列关系式正确的是( )
A.S=![]()
B.c=![]()
C.S=![]()
D.c%=![]() 100%
100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图10 的是
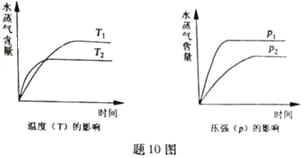
A. CO2(g)+2NH3(g)![]() CO(NH2)2(s)+H2O(g);△H<0
CO(NH2)2(s)+H2O(g);△H<0
B. CO2(g)+H2(g)![]() CO(g)+H2O(g);△H>0
CO(g)+H2O(g);△H>0
C. CH3CH2OH (g)![]() CH2=CH2(g)+H2O(g);△H>0
CH2=CH2(g)+H2O(g);△H>0
D. 2C6H5CH2CH3(g)+O2(g)![]() 2 C6H5CH=CH2(g)+2H2O(g);△H<0
2 C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向27.2 g Cu和Cu2O的混合物中加入某浓度的稀HNO3500 mL,反应过程中产生的气体只有NO。固体完全溶解后,在所得溶液(金属阳离子只有Cu2+)中加入1 L 1 mol·L-1的NaOH溶液使金属离子恰好完全沉淀,此时溶液呈中性,所得沉淀质量为39.2 g。
(1)Cu与稀HNO3反应的离子方程式为__。
(2)Cu与Cu2O 的物质的量之比为__。
(3)HNO3的物质的量浓度为__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某蓄电池放电、充电时的反应为:Fe+Ni2O3+3H2O![]() Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
Fe(OH)2+2Ni(OH)2 下列推断中正确的是( )
放电时,Fe为正极,Ni2O3为负极
②充电时,阴极上的电极反应式是:Fe(OH)2+2e-===Fe+2OH-
③充电时,Ni(OH)2为阳极
④该蓄电池的电极必须是浸在某种碱性电解质溶液中
A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com