
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:

(1)连接上述仪器的正确顺序(填各接口处的字母):___________接_______;________接_________;__________接_________;_________接____________。___________
(2)装置中,饱和食盐水的作用是__________________;NaOH溶液的作用是__________________________________________。
(3)化学实验中常用_____________检验是否有Cl2产生。如果有Cl2产生,可观察到________________,反应方程式_______________________________。
(4)写出下列化学反应的方程式:
①气体发生装置中进行的反应:___________________________
②NaOH溶液中发生的反应:___________________________
(5)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:2KMnO4+16HCl(浓)→2KCl+2MnCl2+5Cl2↑+8H2O。
①标出该反应电子转移的方向和数目_________________
②氧化剂和还原剂的物质的量之比为_____________________;
③当有0.2mole-转移时被氧化的HCl的质量是____________;该反应中被氧化和未被氧化的盐酸的物质的量之比是__________,
④如果将20mL12mol/L的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将_____________。
A.≥1.68L B.> 1.68L C.≤1.68L D.<1.68L
【答案】ECDABHGF 除去氯气中的![]() 杂质 吸收过量的氯气 湿润的淀粉碘化钾试纸 试纸变蓝 2KI+Cl2=2KCl+I2 MnO2+4HCl(浓)
杂质 吸收过量的氯气 湿润的淀粉碘化钾试纸 试纸变蓝 2KI+Cl2=2KCl+I2 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O Cl2+2NaOH=NaCl+NaClO+H2O
MnCl2+Cl2↑+2H2O Cl2+2NaOH=NaCl+NaClO+H2O 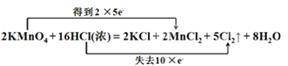 (或
(或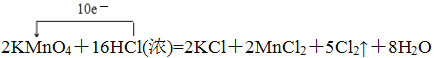 ) 1∶5 7.3g 5:3 D
) 1∶5 7.3g 5:3 D
【解析】
(1)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,需要发生装置生成氯气,用饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,导气管长进短处收集氯气,最后用氢氧化钠溶液吸收多余的氯气;
(2)饱和食盐水是用来除去氯气中的氯化氢气体,氯气有毒,据此分析解答;
(3)氯气具有氧化性,能够氧化碘离子生成单质碘;
(4)①二氧化锰和浓盐酸加热反应生成氯气的反应;②氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水;据此书写反应的方程式;
(5)①依据元素化合价的变化,结合氧化还原反应的双线桥或单线桥标出电子转移方向和数目;②依据氧化还原反应中元素化合价的变化判断氧化剂和还原剂,计算氧化剂和还原剂的物质的量之比;③结合①的分析计算;④根据方程式计算,再从浓盐酸易挥发,装置中的氯气不能被全部赶出等因素考虑判断。
(1)在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气,需要发生装置生成氯气,用饱和食盐水除去氯化氢,通过浓硫酸除去水蒸气,然后排空气法收集氯气,导气管需要长进短出,最后用氢氧化钠溶液吸收多余的氯气,因此装置连接顺序是E-C,D-A,B-H,G-F,故答案为:ECDABHGF;
(2)饱和食盐水是用来除去氯气中的氯化氢气体,降低氯气的溶解度;氯气有毒,会污染空气,用氢氧化钠溶液吸收,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,可以防止尾气污染,故答案为:除去挥发出的氯化氢气体;吸收过量的氯气;
(3)氯气具有氧化性,遇到淀粉碘化钾溶液会氧化碘离子为碘单质,碘遇淀粉变蓝,反应的化学方程式为:2KI+Cl2=2KCl+I2,故答案为:湿润的淀粉碘化钾试纸;试纸变蓝;2KI+Cl2=2KCl+I2 ;
(4)①气体发生装置中发生二氧化锰和浓盐酸加热反应生成氯气的反应,反应的化学方程式为:MnO2+4HCl ![]() MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl
MnCl2+Cl2↑+2H2O,故答案为:MnO2+4HCl ![]() MnCl2+Cl2↑+2H2O;
MnCl2+Cl2↑+2H2O;
②氯气有毒,用氢氧化钠溶液吸收,氯气和氢氧化钠反应生成氯化钠、次氯酸钠和水,反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(5)①2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O中锰元素化合价从+7价降低到+2价;氯元素化合价从-1价升高为0价,转移10个电子,电子转移的方向和数目用双线桥可以表示为: ,用单线桥可以表示为:
,用单线桥可以表示为: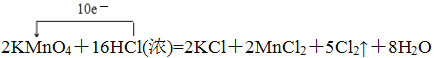 ,故答案为:
,故答案为: (或
(或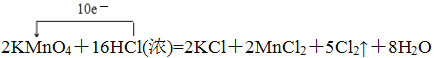 );
);
②2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O,锰元素化合价从+7价降低到+2价;氯元素化合价从-1价升高为0价,氧化剂高锰酸钾为2mol,则还原剂HCl为10mol,氧化剂和还原剂的物质的量之比为1∶5,故答案为:1∶5;
③依据化学方程式可知每转移10mol电子,被氧化的HCl为10mol,当有0.2mole-转移时被氧化的HCl的物质的量为0.2mol,质量=0.2mol×36.5g/mol=7.3g;反应中氯化氢中元素化合价变化的被氧化,元素化合价不变的未被氧化,所以该反应中被氧化和未被氧化的盐酸的物质的量之比=10∶6=5∶3,故答案为:7.3g;5∶3;
④将20mL12molL-1的浓盐酸溶液中含有0.24mol HCl,与足量KMnO4充分反应理论上生成氯气的物质的量0.24mol×![]() =0.075mol,标准状况下体积=0.075mol×22.4L/mol=1.68L;反应过程中浓盐酸易挥发,不能完全反应,装置中的氯气不能被全部赶出等因素,导致收集的气体减少,所以实际收集到的氯气体积标准状况下小于1.68L,故答案为:D。
=0.075mol,标准状况下体积=0.075mol×22.4L/mol=1.68L;反应过程中浓盐酸易挥发,不能完全反应,装置中的氯气不能被全部赶出等因素,导致收集的气体减少,所以实际收集到的氯气体积标准状况下小于1.68L,故答案为:D。


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体在2L的密闭容器中混合并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g);△H<0。4s后反应达到平衡状态,此时测得C的浓度为0.6 mol·L-1。下列说法中,正确的是
2C(g);△H<0。4s后反应达到平衡状态,此时测得C的浓度为0.6 mol·L-1。下列说法中,正确的是
A. 当A、B、C物质的量浓度之比为2︰1︰2时,反应即达到平衡状态
B. 4s内用物质B表示的反应速率为0.075 molL-1s-1
C. 达平衡后若通入一定量氦气,A的转化率降低
D. 达平衡后若升高温度,C的浓度将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某体积固定的密闭容器中加入0.3 mol A、0.1 mol C和一定量(未知)的B三种气体,一定条件下发生反应,各物质浓度随时间变化如图所示。已知在反应过程中混合气体的平均相对分子质量没有变化。请回答:

(1)密闭容器的体积是_____L;
(2)若t1=15时,则t0~t1 s内以C物质浓度变化表示的反应速率v(C)=_______;
(3)写出反应的化学方程式:________________________;
(4)t1 s时,A的转化率为__________,此时v(A)正______v(B)逆(选填“>”、“<”或“=”);
(5)B的起始的物质的量是_____;
(6)平衡时体系内的压强为初始状态的___________倍。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,纯水的电离度为α1,pH=3的醋酸中水的电离度为α2,pH=11的氢氧化钠溶液中水的电离度为α3。若将上述醋酸溶液和氢氧化钠溶液等体积混合,所得溶液中水的电离度为α4,则下列关系正确的是
A. α1<α3<α2<α4 B. α3<α2<α1<α4 C. α2=α3<α1<α4 D. α2=α3<α4<α1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于水解反应的是( )
A. CO32-+H2O![]() HCO3-+OH- B. Fe3++3HCO3-=Fe(OH)3↓ +3CO2↑
HCO3-+OH- B. Fe3++3HCO3-=Fe(OH)3↓ +3CO2↑
C. A1O2-+HCO3-+H2O=Al(OH)3↓+CO32- D. Al3++3A1O2-+6H2O=4Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二元弱碱B(OH)2在水中存在如下电离平衡:B(OH)2 ![]() B(OH)++OH-,Kb1=10-3.75;B(OH)+
B(OH)++OH-,Kb1=10-3.75;B(OH)+![]() B2++OH-,Kb2=10-7.62。常温下,用0.1 mol/L盐酸滴定25 mL 0.1 mol/L的B(OH)2溶液,得到如图所示的滴定曲线。下列说法不正确的是
B2++OH-,Kb2=10-7.62。常温下,用0.1 mol/L盐酸滴定25 mL 0.1 mol/L的B(OH)2溶液,得到如图所示的滴定曲线。下列说法不正确的是

A. a点所得的溶液中:c[B(OH)2]= c[B(OH)+]
B. b点所得的溶液中:c[B(OH)2] +c(OH-)=c(B2+)+c(H+)
C. c点所得的溶液中:c(Cl-)<3c[B(OH)+]
D. d点所得的溶液中:c(B2+)>c[B(OH)+]>c[B(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1000mol·L-1标准氢氧化钠溶液滴定未知浓度的盐酸,其操作可分解为如下几步:
A. 取20.00mL待测盐酸溶液注入洁净的锥形瓶中并加入2~3滴酚酞试液
B. 用标准氢氧化钠溶液润洗滴定管2~3次
C. 把盛有标准氢氧化钠溶液的碱式滴定管固定好,调节滴定管的尖嘴使之充满溶液
D. 取标准氢氧化钠溶液注入碱式滴定管至“0”刻度以上2~3mL处
E. 调节液面至“0” 或“0”刻度以下,记下读数
F. 把锥形瓶放在滴定管的下面,用标准氢氧化钠溶液滴定至终点并记下滴定管的读数
回答下列问题:
(1)正确的操作顺序是:B、________________、F(填序号);
(2)上述B步骤的操作目的是________________。
(3)上述A步骤操作之前,若先用待测液润洗锥形瓶,则对滴定结果的影响是_____(填“偏大”、“偏小”或“无影响)。
(4)判断到达滴定终点的实验现象为________________。
(5)若滴定结束时,滴定管液面如图所示,则终点读数为_________mL。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】冶炼金属一般有下列四种方法:①焦炭法、②水煤气(或氢气,或一氧化碳)法、③活泼金属置换法、④电解法。四种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜、(Ⅱ)湿法炼铜、(Ⅲ)铝热法炼铬、(Ⅳ)从光卤石中炼镁,对它们的冶炼方法分析不正确的是( )
A.Ⅰ用①B.Ⅱ用②C.Ⅲ用③D.Ⅳ用④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com