
| 元素编号 | 元素性质或原子结构 |
| T | M层上有2对成对电子 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 元素最高正价是+7价 |
14 6 |
14 6 |
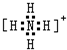 ,故答案为:
,故答案为: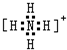 ;
;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、X>Y>Z |
| B、X>Z>Y |
| C、Y>X>Z |
| D、Y>Z>X |
查看答案和解析>>
科目:高中化学 来源: 题型:
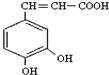 )也叫3,4-二羟基桂皮酸,它存在于许多种药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效.
)也叫3,4-二羟基桂皮酸,它存在于许多种药中,如野胡萝卜、光叶水苏、荞麦、木半夏等.咖啡酸有止血作用,对内脏的止血效果较好,毒性较小,还有镇咳、祛痰等疗效.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
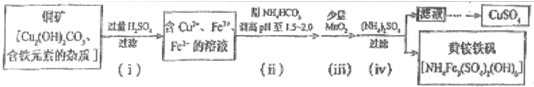
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阳离子 | H+、Na+、A13+、Ag+、Ba2+ |
| 阴离子 | OH-、C1-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (系统命名)
(系统命名)查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水中通入过量二氧化碳Ca2++CO2+2OH-═CaCO3↓+H2O | ||
B、氢氧化钡溶液与稀硫酸反应:Ba2++OH-+H++SO
| ||
| C、氢氧化铜加到稀盐酸中:Cu(OH)2+2H+═Cu2++2H2O | ||
| D、向沸水中滴加FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O═Fe(OH)3↓+3H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com