
【题目】下列物质中,含有共价键的化合物是( )
A. 碘化氢 B. 烧碱 C. 液溴 D. 氯化钠
科目:高中化学 来源: 题型:
【题目】下列化学方程式不正确的是
A. 实验室制乙炔:CaC2+2H2O→Ca(OH)2+C2H2↑
B. 丁二烯的1,4-加成:H2C=CHCH=CH2+Cl2→CH2ClCH=CHCH2Cl
C. 向苯酚钠溶液中加入少量CO2:

D. 乙醛与新制氢氧化铜反应:CH3CHO+2Cu(OH)2+NaOH![]() CH3COONa+Cu2O↓+3H2O
CH3COONa+Cu2O↓+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2015四川卷】(NH4)2SO4是常见的化肥和化工原料,受热易分解。某兴趣小组拟探究其分解产物。
[查阅资料] (NH4)2SO4在260℃和400℃时分解产物不同。
[实验探究]该小组拟选用下图所示装置进行实验(夹持和加热装置略)
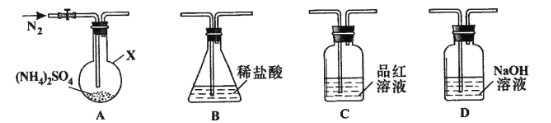
实验1:连接装置A-B-C-D,检查气密性,按图示加入试剂(装置B盛0.5000mol/L盐酸70.00mL)。通入N2排尽空气后,于260℃加热装置A一段时间,停止加热,冷却,停止通入N2。品红溶液不褪色,取下装置B,加入指示剂,用0.2000mol/L NaOH溶液滴定剩余盐酸,终点时消耗NaOH溶液25.00 mL。经检验滴定后的溶液中无SO42-。
(1)仪器X的名称是________________。
(2)滴定前,下列操作的正确顺序是_________(填字母编号)。
a.盛装0.2000mol/L NaOH溶液 b.用0.2000mol/L NaOH溶液润洗
c.读数、记录 d.查漏、清洗 e.排尽滴定管尖嘴的气泡并调整液面
(3)装置B内溶液吸收气体的物质的量是__________mol
实验2:连接装置A-D-B,检查气密性,按图示重新加入试剂。通入N2排尽空气后,于400℃加热装置A至(NH4)2SO4完全分解无残留物,停止加热,冷却,停止通入N2。观察到装置A、D之间的导气管内有少量白色固体。经检验,该白色固体和装置D内溶液中有SO32-,无SO42-。进一步研究发现,气体产物中无氮氧化物。
(4)检验装置D内溶液中有SO32-,无SO42-的实验操作和现象是__________.
(5)装置B内溶液吸收的气体是____________.
(6)(NH4)2SO4在400℃分解的化学方程式是______________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用元素周期律解释的是
A. 酸性:HClO4 > H2SO3 B. 碱性:NaOH > Mg(OH)2
C. 气态氢化物的稳定性:H2O > H2S D. Cl2从NaBr溶液中置换出Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法确的是
A. 水可用来鉴别溴苯和苯
B. 聚苯乙烯不能发生加成反应
C. 用于杀菌消毒的医用酒精质量分数为95%
D. 植物油,动物脂肪和甘油都属于油脂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类以及依据正确的是( )
A. H2SO4是酸,因为H2SO4中含有氢元素
B. 豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间
C. Na和H2O的反应不是离子反应,因为反应中没有离子参加
D. 燃烧必须有氧气参与,因而没有氧气参与的反应一定没有燃烧现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。
(1)已知25℃时,Ksp(BaSO4)=1×10-10,将BaSO4的悬浊液过滤,滤液中c(Ba2+)=_______mol·L-1。取100 mL滤液与100 mL 2 mol·L-1的Na2SO4溶液混合,混合液中c(Ba2+)=___________ mol·L-1。
(2)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率。水垢中含有的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。
①CaSO4转化为CaCO3的离子方程式为:_____________________________________________________
②请分析CaSO4转化为CaCO3的原理:______________________________________________________
Ⅱ.在25 ℃时,HSCN、HClO、H2CO3的电离常数如下表:
HClO | HSCN | H2CO3 |
K=3.2×10-8 | K=0.13 | K1=4.2×10-7 K2=5.6×10-11 |
(1)1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为_________________________________
(2)向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为_______________________________
(3)25 ℃时,为证明HClO为弱酸,某学习小组的同学设计了以下三种实验方案。下列三种方案中,你认为能够达到实验目的的是______________________(填下列各项中序号)。
a.用pH计测量0.1mol·L-1NaClO溶液的pH,若测得pH>7,可证明HClO为弱酸
b.用pH试纸测量0.01 mol·L-1 HClO溶液的pH,若测得pH>2,可证明HClO为弱酸
c.用仪器测量浓度均为0.1 mol·L-1的HClO溶液和盐酸的导电性,若测得HClO溶液的导电性弱于盐酸,可证明HClO为弱酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是
A | B | C | D |
|
|
|
|
钢铁表面水膜的酸性很弱或呈中性,发生吸氧腐蚀 | 钢铁表面水膜的酸性较强,发生析氢腐蚀 | 将锌板换成铜板对钢闸门保护效果更好 | 钢闸门作为阴极而受到保护 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨反应过程中的能量变化如图所示,下列说法错误的是( )

A. 反应体系中加入催化剂,不会改变反应的热效应
B. 反应物的总能量高于生成物的总能量
C. 该反应的热化学方程式为3H2+N2![]() 2NH3 ΔH=Q(Q>0)
2NH3 ΔH=Q(Q>0)
D. 该反应是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com