
【题目】美国斯坦福大学的工程师设计出一种从污水“提取”潜在电能的新型微生物电池,该电池能将生活污水中的有机物分解同时发电,电池结构如图所示。已知a电极为惰性材料,b电极为Ag2O。下列说法不正确的是( )
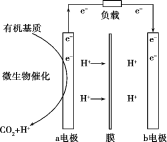
A.a电极是负极,b电极是正极
B.b电极发生的反应是Ag2O+2e-+2H+=2Ag+H2O
C.a电极每生成标准状况下2.24LCO2,可向b电极转移0.1mol电子
D.高温条件下,该电池不能正常工作
科目:高中化学 来源: 题型:
【题目】某探究活动小组根据侯德榜制碱原理,按下面设计的方案制备碳酸氢钠。实验装置如下图所示(图中夹持、固定用的仪器未画出)。下列说法正确的是

A. 乙装置中盛放的是饱和食盐水
B. 丙装置中的溶液变浑浊,因有碳酸氢钠晶体析出
C. 丁装置中倒扣的漏斗主要作用是防止产生的气体污染空气
D. 实验结束后,分离碳酸氢钠的操作是蒸发结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铁是合成草酸铁的重要原料。
利用工业FeCl3制取纯净的草酸铁晶体[Fe2(C2O4)3·5H2O]的实验流程如下图所示:

(1)抑制FeCl3水解,溶液X为___________。
(2)流程中FeCl3能被异丙醚萃取,其原因是__________________________;检验萃取、分液后所得水层中是否含有Fe3+的方法是_______________________________________。
(3)得Fe2(C2O4)3·5H2O需用冰水洗涤,其目的是________________________。
(4)为测定所得草酸铁晶体的纯度,实验室称取a g样品,加硫酸酸化,用KMnO4标准溶液滴定生成的H2C2O4,KMnO4标准溶液应置于下图所示仪器_____(填“甲”或“乙”)中。
![]()
下列情况会造成实验测得Fe2(C2O4)3·5H2O含量偏低的是_____________。
a.盛放KMnO4的滴定管水洗后未用标准液润洗
b.滴定管滴定前尖嘴部分有气泡,滴定后消失
c.滴定前仰视读数,滴定后俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 是一种在药物合成中有重要作用的有机物,下列关于该有机物的说法正确的是
是一种在药物合成中有重要作用的有机物,下列关于该有机物的说法正确的是
A.该有机物在一定条件下能发生酯化反应、还原反应、氧化反应、加成反应、消去反应
B.该有机物中有4种官能团
C.1mol该有机物分别与足量的碳酸氢钠溶液、金属钠反应,产生气体的物质的量不相同
D.该有机物的分子式为C14H16O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将H2S转化为可再利用的资源是能源研究领域的重要课题。某转化工作原理如图。该装置工作时,下列叙述错误的是( )
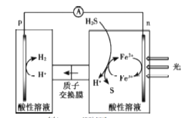
A.p电极的电极反应:2H++2e-=H2
B.该方法能实现由H2S高效产生S和H2
C.光照后,n电极的电极反应:H2S-2e-=2H++S
D.除了Fe3+/Fe2+外,I3-/I-也能实现如图所示循环
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业合成氨的反应为N2(g)+3H2(g)![]() 2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为
2NH3(g)。设在容积为2.0 L的密闭容器中充入0.60 mol N2(g)和1.60 mol H2(g),反应在一定条件下达到平衡时,NH3的物质的量分数(NH3的物质的量与反应体系中总的物质的量之比)为![]() 计算:
计算:
(1)该条件下N2的平衡转化率______;(小数点后保留一位)
(2)该条件下反应2NH3(g)![]() N2(g)+3H2(g)的平衡常数_______。(不带单位)
N2(g)+3H2(g)的平衡常数_______。(不带单位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己烯雌酚是一种激素类药物,其结构简式如图所示。下列有关叙述中不正确的是( )
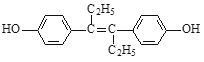
A. 己烯雌酚的分子式为C18H20O2
B. 己烯雌酚分子中一定有16个碳原子共平面
C. 己烯雌酚为芳香族化合物
D. 己烯雌酚可发生加成、取代、氧化、加聚、酯化、硝化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组的同学们想要探究锰的性质,进行了下列实验和探究。
Ⅰ![]() 的制取:在查阅资料后,兴趣小组的同学们设计了以软锰矿石
的制取:在查阅资料后,兴趣小组的同学们设计了以软锰矿石![]() 为原料制取
为原料制取![]() 的步骤,并实验室模拟制备。
的步骤,并实验室模拟制备。
![]()
![]() 已知溶液Ⅰ中Mn为
已知溶液Ⅰ中Mn为![]() 价
价![]()
(1)在“碱熔氧化”时,既可将![]() 与KOH混合物熔融后通入氧气,也可加入
与KOH混合物熔融后通入氧气,也可加入![]() 作为氧化剂。请分析哪种方法更合适并简述理由:________。
作为氧化剂。请分析哪种方法更合适并简述理由:________。
(2)步骤①是________。酸化过程中只需通入过量![]() 即可,请写出对应的离子方程式:_________。
即可,请写出对应的离子方程式:_________。
(3)实际上用这种方法制取![]() 效率很低。若工业上要用此法制取
效率很低。若工业上要用此法制取![]() ,应_______以提高原料的利用率。在实际生产过程中,还可用Ni为阳极、Fe为阴极电解溶液Ⅰ以获得高浓度的
,应_______以提高原料的利用率。在实际生产过程中,还可用Ni为阳极、Fe为阴极电解溶液Ⅰ以获得高浓度的![]() 溶液,试写出阴极的电极反应方程式:_______。
溶液,试写出阴极的电极反应方程式:_______。
Ⅱ![]() 的成分探究:化学实验室存有一瓶开封已久的
的成分探究:化学实验室存有一瓶开封已久的![]() 试剂,化学兴趣小组欲研究该
试剂,化学兴趣小组欲研究该![]() 的纯度。
的纯度。
(1)打开试剂瓶时,有一股气流冲出。甲同学取少量粉末于试管中,加适量蒸馏水振荡,发现固体部分溶解,试管底部沉积有少量黑色不溶物,且溶解过程中管壁发热明显。甲同学查阅资料得知:![]() 变质时有
变质时有![]() 和两种含锰物质生成,且含锰物质中,较高氧化态物质与较低氧化态物质的物质的量之比为
和两种含锰物质生成,且含锰物质中,较高氧化态物质与较低氧化态物质的物质的量之比为![]() 。试写出
。试写出![]() 受热分解的化学方程式:________。
受热分解的化学方程式:________。
为进一步确定![]() 的纯度,乙同学和丙同学先后进行了以下实验;
的纯度,乙同学和丙同学先后进行了以下实验;
①取![]() 样品溶于试管中,过滤,得到黑色固体和滤液1;
样品溶于试管中,过滤,得到黑色固体和滤液1;
②洗涤黑色固体,留取洗涤液,重复三次;
③用分析天平称量黑色固体,其质量为![]() 。
。
(2)据此,乙同学计算得出![]() 的纯度为________
的纯度为________![]() 。
。
在乙同学的实验的基础上,丙同学继续完成了以下实验:
④将②中的洗涤液加入滤液1中,在滤液1中逐滴滴加![]() 溶液,直到灰绿色固体不再增加为止;
溶液,直到灰绿色固体不再增加为止;
⑤过滤,得滤液2,洗涤灰绿色固体并留取洗涤液,重复三次;
⑥将⑤中的洗涤液加入滤液2中,加水标定至![]() ,酸化后用标准液A进行滴定操作,每次取样
,酸化后用标准液A进行滴定操作,每次取样![]() ,总共重复进行了四次滴定实验。
,总共重复进行了四次滴定实验。![]() 提示:
提示:![]()
(3)若步骤④未将②中洗涤液加入滤液1中,会导致最终滴定结果________![]() 填“偏大”“偏小”或“不变”
填“偏大”“偏小”或“不变”![]() 。
。
(4)标准液A可选用下列的________![]() 填字母序号
填字母序号![]() 。
。
a.![]() 溶液 b.
溶液 b.![]() 溶液
溶液
c.![]() 酸性NaI溶液 d.
酸性NaI溶液 d.![]() 酸性
酸性![]() 溶液
溶液
(5)完成所有滴定实验后,最终丙同学计算出![]() 的纯度比乙同学计算所得的数据偏小,请结合上述实验操作分析两位同学实验结果差异较大的原因是______________
的纯度比乙同学计算所得的数据偏小,请结合上述实验操作分析两位同学实验结果差异较大的原因是______________![]() 写2条
写2条![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com