
【题目】一定温度下,向一容积为2L的恒容密闭容器中充入2molA与3molB,在一定条件下反应:A(g)+B(g)C(g),△H >0,达到平衡后容器内压强是开始时的84%。若加入某种催化剂后反应的能量变化如图所示。下列说法正确的是( )

A.由图可知,加入催化剂之后,原反应分成了两步,第一步反应较慢
B.若40s后达到平衡,则用A表示该反应的速率为0.01molL-1min-1
C.当容器c(B)/c(A)不再改变时,不能说明该反应达到了平衡状态
D.达到平衡时,C的体积分数约为25%
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中进行反应:X2(g)+3Y2(g)![]() 2Z(g),其中X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )。
2Z(g),其中X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )。
A.c(Z)=0.5 mol·L-1B.c(Y2)=0.5 mol·L-1
C.c(X2)=0.2 mol·L-1D.c(Y2)=0.6 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L。下列各组混合烃中不符合此条件的是( )
A.CH4 C2H4B.CH4 C3H6
C.C2H4 C3H4D.C2H4 CH4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧锂离子电池的正极材料试样(主要含有LiCoO2及少量Al、Fe等)可通过下列实验方法回收钴,并制备金属锂。
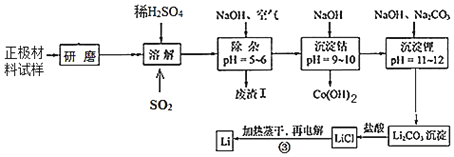
已知:①部分金属氢氧化物开始沉淀和完全沉淀时的pH:
氢氧化物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 |
开始沉淀pH | 2.7 | 3.7 | 9.6 |
完全沉淀pH | 3.7 | 4.7 | 11 |
②Li2CO3在不同温度下的溶解度如下表:
温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
(1)LiCoO2中,Co元素的化合价为_____。
(2)上述流程中为加快化学反应速率而采取的措施是_____。
(3)在上述溶解过程中,通入SO2的目的为_____。
(4)加NaOH调pH的目的是_____。
(5)写出“沉钴”过程中发生反应的离子方程式_____。
(6)洗涤所得Li2CO3沉淀要使用_____(填“热水”或“冷水”),将氯化锂溶液蒸干的过程中还需不断通入HCl气体,其作用是_____。
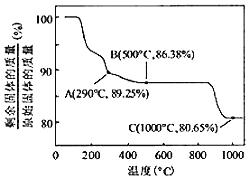
(7)Co(OH)2在空气中加热时,固体残留率随温度的变化如图所示。已知钴的氢氧化物加热至290℃时已完全脱水,则1000℃时,剩余固体的成分为_____(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在恒容密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g)。当SO2、O2、SO3的浓度不再变化时,下列说法正确的是
2SO3(g)。当SO2、O2、SO3的浓度不再变化时,下列说法正确的是
A. 该反应已达化学平衡状态B. 正、逆反应速率相等且等于零
C. SO2和O2全部转化为SO3D. SO2、O2、SO3的浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组关于强电解质、弱电解质、非电解质、混合物的归类,完全正确的是( )
A | B | C | D | |
强电解质 | Fe | NaCl |
|
|
弱电解质 |
|
|
|
|
非电解质 | 蔗糖 |
| 苯 |
|
混合物 | 碱石灰 | 胆矾 | 碘酒 | 液氯 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海洋中提取碘的流程如下:
![]()
某化学兴趣小组将上述流程②③设计成如图所示:
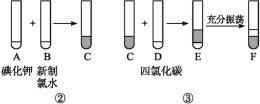
已知②中发生反应的化学方程式为Cl2+2KI![]() 2KCl+I2。
2KCl+I2。
回答下列问题:
(1)写出提取过程①③中实验操作名称:①____,③____。
(2)四氯化碳是____色、密度比水的密度____的液体。F中下层液体的颜色为____色,上层液体中溶质的主要成分为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的值。俗名为“臭碱”的硫化钠广泛应用于治金、染料、皮革、电镀等工业。硫化钠的一种制备方法是Na2SO4+2C![]() Na2S+2CO2↑。下列有关说法正确的是
Na2S+2CO2↑。下列有关说法正确的是
A. 1L.0.25mol/L.Na2SO4溶液中含有的氧原子数目为NA
B. 1L.0.1mol/LNa2S溶液中含有的阴离子数目小于0.1NA
C. 生成1mol还原产物时转移电子数为8NA
D. 通常状况下,11.2L.CO2中含有的共价键数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是个农业大国,农业是立国之本,化肥与农药的发展对农业起着巨大的推动作用。请回答下列问题:
(1)农作物生长过程中不可缺少的微量元素有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 等,它们或是酶的组成成分,或能提高酶的活性,是农作物体内营养物质形成和新陈代谢不可缺少的元素。常用铜肥是胆矾,在盐碱地(土壤
等,它们或是酶的组成成分,或能提高酶的活性,是农作物体内营养物质形成和新陈代谢不可缺少的元素。常用铜肥是胆矾,在盐碱地(土壤![]() )施用胆矾时宜将溶液_____________(填“喷在叶片上”或“随水灌人土壤中”),原因是_______________________。
)施用胆矾时宜将溶液_____________(填“喷在叶片上”或“随水灌人土壤中”),原因是_______________________。
(2)农药波尔多液是一种常用的杀菌剂,常用配方为硫酸铜、熟石灰、水,三者按一定质量比混合,分析其防治病虫害的原因________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com