
����Ŀ���Ȼ��У�C6H5CH2Cl����һ����Ҫ���л���ѧԭ�ϡ���ҵ�ϲ��üױ�����������ڹ��������·�Ӧ�ϳ��Ȼ��С�
��1��д��ʵ������ȡ�����Ļ�ѧ����ʽ___��
��2�������з��������Ȼ��дֲ�Ʒ�Ĵ��ȡ�
����1����ȡ5.11g��Ʒ����ƿ�У�����200.00mL4mol/L����������Һ���ȣ���ȴ�����¡����� 200.00mL4mol/L���ᣬһ��ʱ�����ƿ�е���Һȫ��ת����250.00 mL ������ƿ��,��ˮ���ݡ�
�������ƿ�и���25.00 mL��Һ����ֻ��ƿ�У�������25.00 mL0.2000mol/L��������Һ��
�i���:�����������ָʾ������0.2000 mol/LNH4SCN��Һ�ֱ�ζ�ʣ��������������õζ��������±���
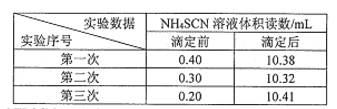
�ټ��������Ŀ����_________��
���ڲ��������У��жϴﵽ�ζ��յ��������_______��
�۸���Ʒ���Ȼ��е�����������д��������̣�__________��
�������ⶨ���ӭ�������Ȼ�������Ԫ�ص����ۺ�����ԭ����_______��
���𰸡�MnO2+4HCl (Ũ) ![]() MnCl2+Cl2��+2H2O �к�NaOHʹ��Һ�����ԣ���ֹOH������һ���ĸ��� ���������һ��NH4SCN��Һ����Һ��Ϊ��ɫ���Ұ�����ڲ���ɫ 126.5g��mol-1����0.2000 mol��L-1��0.0250L��0.2000 mol��L-1��0.01000L����10��5.11g��100%=74.27% �ױ��������ڹ��������¿������ɶ��ȴ��Cl2�����ɵ�HClҲ����ɲⶨ���ƫ��
MnCl2+Cl2��+2H2O �к�NaOHʹ��Һ�����ԣ���ֹOH������һ���ĸ��� ���������һ��NH4SCN��Һ����Һ��Ϊ��ɫ���Ұ�����ڲ���ɫ 126.5g��mol-1����0.2000 mol��L-1��0.0250L��0.2000 mol��L-1��0.01000L����10��5.11g��100%=74.27% �ױ��������ڹ��������¿������ɶ��ȴ��Cl2�����ɵ�HClҲ����ɲⶨ���ƫ��
��������
(1)ʵ��������MnO2��Ũ�����ϼ�����ȡ������
(2)�ټ���������к�����������Һ����ֹ���������Ӹ������Ӽ��飻
�����������ָʾ������0.2000mol/LNH4SCN��Һ�ֱ�ζ�ʣ������������������һ����Һ��Ѫ��ɫ�Ұ���Ӳ���˵����Ӧ�ﵽ�յ㣻
�۽ṹ��Ԫ���غ���㣬����NH4SCN+AgNO3�TAgSCN��+NH4NO3����ʣ�����������������������Һ���������ʵ�����ȥʣ������������ʵ����õ������Ȼ������������ʵ�������Ԫ���غ�õ��Ȼ������ʵ������ݴ˼��㣻
�ܼױ��������ڹ��������¿������ɶ��ȴ���������Ȼ������������ӵIJⶨ��
(1)ʵ��������MnO2��Ũ�����ϼ�����ȡ������������Ӧ�Ļ�ѧ����ʽΪMnO2+4HCl (Ũ) ![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
(2)�������������ָʾ������0.2000mol/LNH4SCN��Һ�ֱ�ζ�ʣ���������������õ��������������Ӵ��ڻ�������������������������ֵ�IJⶨ�����������Ŀ���ǣ��к�NaOHʹ��Һ�����ԣ���ֹOH-����һ���ĸ��ţ�
�����������ָʾ������0.2000mol/LNH4SCN��Һ�ֱ�ζ�ʣ������������������һ����Һ��Ѫ��ɫ�Ұ���Ӳ���˵����Ӧ�ﵽ�յ㣬�жϴﵽ�ζ��յ�������ǣ����������һ�Σ���Һ����ɫ��Ϊ��ɫ���Ұ�����ڲ���ɫ��
�۳�ȡ5.11g��Ʒ����ƿ�У�����200.00mL4mol/L����������Һ���ȣ���ȴ�����£�����200.00mL4mol/L���ᣬһ��ʱ�����ƿ�е���Һȫ��ת����250.00mL������ƿ�У���ˮ���ݣ�������ƿ�и�ȡ25.00mL��Һ����ֻ��ƿ�У�������25.00mL0.2000mol/L��������Һ�������βⶨ������ϴ�NH4SCN��Һ�������ȡƽ��ֵΪ��![]() =10.00ml�����������������ʵ���=0.2000mol/L��0.0100L�����������ӷ�Ӧ�����������ʵ���=0.2000mol/L��0.02500L-0.2000mol/L��0.0100L��250.00ml��Һ���������ӷ�Ӧ�����������ʵ���=(0.2000mol/L��0.02500L-0.2000mol/L��0.0100L)��
=10.00ml�����������������ʵ���=0.2000mol/L��0.0100L�����������ӷ�Ӧ�����������ʵ���=0.2000mol/L��0.02500L-0.2000mol/L��0.0100L��250.00ml��Һ���������ӷ�Ӧ�����������ʵ���=(0.2000mol/L��0.02500L-0.2000mol/L��0.0100L)��![]() ����ȡ5.11g��Ʒ���Ȼ��е���������=
����ȡ5.11g��Ʒ���Ȼ��е���������=![]() ��100%=74.27%��
��100%=74.27%��
�������ⶨ���ͨ�������Ȼ�������Ԫ�ص����ۺ�����ԭ���ǣ��ױ��������ڹ��������¿������ɶ��ȴ��Cl2�����ɵ�HClҲ����ɲⶨ���ƫ�ߣ�
�ʴ�Ϊ���ױ��������ڹ��������¿������ɶ��ȴ��Cl2�����ɵ�HClҲ����ɲⶨ���ƫ�ߡ�


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪʵ������ȡ��������������װ��ͼ.���й��ڸ�ʵ���������,����ȷ����
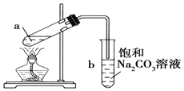
A. ��a�Թ����ȼ���Ũ����,Ȼ���ҡ���Թܱ����������Ҵ�,�ټӱ�����
B. �Թ�b�е������¶˹ܿڲ��ܽ���Һ���ԭ���Ƿ�ֹʵ������з�����������
C. ʵ��ʱ�����Թ�a��Ŀ���Ǽ�ʱ�����������������ӿ췴Ӧ����
D. ���ó����������е���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)��H=-akJmol-1����5L�ܱ�����Ͷ��1molNH3��1mol��O2��2���Ӻ�NO�����ʵ���������0.4mol������˵����ȷ���ǣ� ��
4NO(g)+6H2O(g)��H=-akJmol-1����5L�ܱ�����Ͷ��1molNH3��1mol��O2��2���Ӻ�NO�����ʵ���������0.4mol������˵����ȷ���ǣ� ��
A.2���ӷ�Ӧ�ų�������ֵС��0.1akJ
B.��������ʾ0��2min�ķ�Ӧ���ʣ�v(O2)=0.05mol��L-1��min-1
C.2������NH3��ת������50%
D.2����ĩc(H2O)=0.6mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ե�ʯ��[��Ҫ�ɷ�Ca(0H)2����Fe203��MgO��Si02������]Ϊԭ���Ʊ�����̼��Ƶġ��ֹ����������£�
��1����ʯ������ˮ�γɵ�ʯ����ʱ�ᷢ����Ӧ�����ɵ������г�ˮ���______��
��2�������ա�ʱ��NH4Cl��Ca(0H)2��Ӧ�Ļ�ѧ����ʽΪ______��
��3�������ա�ʱ��һ��ʱ����Ca2+��ȡ�����¶ȱ仯��ͼ��ʾ��Ca2+��ȡ�����¶����߶�������ԭ�������______��
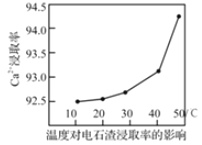
A.�¶����ߣ������ȡ��Ӧ���ʣ��Ӷ����Ca2+��ȡ��
B.�¶����ߣ���Һ���ȼ�С���Ӷ����Ca2+��ȡ��
C.�¶����ߣ�NH4Cl��Һˮ��̶ȼ�С���Ӷ����Ca2+��ȡ��
��4����̼����ʱ��-����õ��¹��գ���Ӧ�����ӷ���ʽΪ___��
��5����Һ���У���ѭ�����õ����ʵĻ�ѧʽΪ___��
��6����ϴ�ӡ�ʱ�������Ƿ�ϴ���ķ�����:__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������֦���ΪijЩ�����о����ȵ㣬��ṹ��ͼ��ʾ�����й��ڷ�֦���˵������ȷ����( )
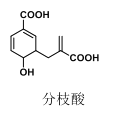
A.�û�����ķ���ʽΪC11H12O5���Һ������ֹ�����
B.��ʹ���Ը��������Һ��ɫ��Ҳ��ʹ������Ȼ�̼��Һ��ɫ����ԭ����ͬ
C.1mol ��֦��������� 3mol NaOH �����кͷ�Ӧ
D.1mol ��֦����1mol Br2�����ӳɷ�Ӧ�����ܵõ�4 �ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ͻ���������й㷺Ӧ�ã�ij��ȤС��Ϊ���÷����������Ͻ����������ʵ�������Ʊ��ۺ���������������
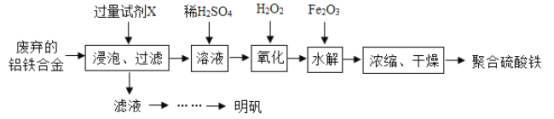
��1��������Ksp[Fe(OH)3]=4��l0-38�Ʊ�Fe(OH)3�Ĺ����У�pH=7ʱ��Һ��c(Fe3+) =________��
��2���ۺ���������һ���ެ��ѡ���ѧ�����ȶ�������ˮ���ܵ������������������Ҵ����仯ѧʽ�ɱ�ʾΪ[Fe2(OH)x(SO4)y]n��
��д�������е���������ʱ���������ӷ���ʽ_______��Ũ��ʱ�����м���һ�������Ҵ��������Ҵ���Ŀ����_________��
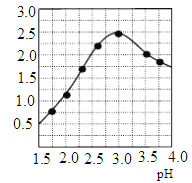
�ڼ����Լ�Y��Ŀ���ǵ���pH�������Լ�YΪ_______����ҺpH��[Fe2(OH) x (SO4)y]n��x��ֵ�нϴ�Ӱ�죨��ͼ��ʾ�����Է���pH��С��pH��3�����¾ۺ���������x��ֵ��С��ԭ��____________��
��3��������һ�ֳ������������Ρ�
��Ϊ�������ԭ�ϣ��Լ�XӦΪ_______��
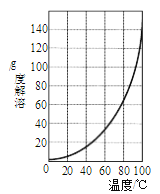
������ͼ��ʾ�������ܽ�����ߣ�������������ҺI�Ʊ����������ʵ�鲽��(��ѡ�õ��Լ��������������Ͻ�ϡ���ᡢNaOH��Һ�;ƾ�)������ҺI�м��������ĺ�������м�����������ݲ��������ˣ�_____������Һ_______�����ˡ����þƾ�ϴ�ӡ�������յõ��������塣
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͪ�����һ�����õĿ�����ʹҩ������ͨ�����·����ϳɣ�
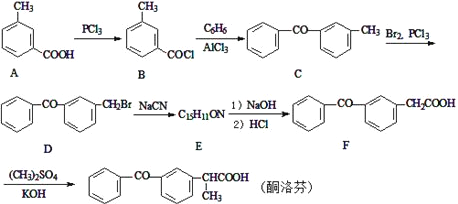
(1)������D�����������ŵ�����Ϊ___��
(2)������E�Ľṹ��ʽΪ________����B��C�ķ�Ӧ������____��
(3)д��C��D�ķ�Ӧ����ʽ_____��
(4)д��ͬʱ��������������A��һ��ͬ���칹��Ľṹ��ʽ____��
I.�ܷ���������Ӧ��
��.��FeCl3������ɫ��Ӧ��
��.�����к���5�ֲ�ͬ��ѧ��������
(5)��д���Լױ�Ϊԭ���Ʊ�������![]() �ĺϳ�·������ͼ�����Լ����л��ܼ�����ѡ���ϳ���·����ͼʾ������������ɣ�____��
�ĺϳ�·������ͼ�����Լ����л��ܼ�����ѡ���ϳ���·����ͼʾ������������ɣ�____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����15�֣��⼰�仯�����ںϳ�ɱ������ҩ��ȷ�����й㷺��;���ش��������⣺
��1�������ĵ⸻���ں����У���ˮ��ȡ��Ũ��������Ũ��Һ�м�MnO2��H2SO4�����ɵõ�I2���÷�Ӧ�Ļ�ԭ����Ϊ____________��
��2������Ũ��Һ�к���I-��Cl-�����ӣ�ȡһ������Ũ��Һ�������еμ�AgNO3��Һ����AgCl��ʼ����ʱ����Һ��![]() Ϊ��_____________����֪Ksp��AgCl��=1.8��10-10��Ksp��AgI��=8.5��10-17��
Ϊ��_____________����֪Ksp��AgCl��=1.8��10-10��Ksp��AgI��=8.5��10-17��
��3����֪��Ӧ2HI(g) ===H2(g) + I2(g)����H= +11kJ��mol��1��1mol H2(g)��1mol I2(g)�����л�ѧ������ʱ�ֱ���Ҫ����436kJ��151kJ����������1molHI(g)�����л�ѧ������ʱ�����յ�����Ϊ______________kJ��
��4��Bodensteins�о������з�Ӧ��2HI(g)![]() H2(g) + I2(g)
H2(g) + I2(g)
��716Kʱ�����������е⻯������ʵ�������x(HI)�뷴Ӧʱ��t�Ĺ�ϵ���±���
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
����������ʵ�������÷�Ӧ��ƽ�ⳣ��K�ļ���ʽΪ��___________��
��������Ӧ�У�����Ӧ����Ϊv��= k����x2(HI)���淴Ӧ����Ϊv��=k����x(H2)��x(I2)������k����k��Ϊ���ʳ�������k��Ϊ________(��K��k����ʾ)����k�� = 0.0027min-1����t=40minʱ��v��=________min-1
��������ʵ�����ݼ���õ�v��~x(HI)��v��~x(H2/span>)�Ĺ�ϵ������ͼ��ʾ�������ߵ�ijһ�¶�ʱ����Ӧ���´ﵽƽ�⣬��Ӧ�ĵ�ֱ�Ϊ_________________������ĸ��
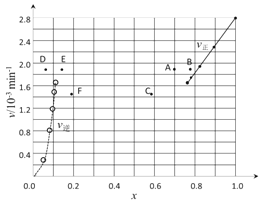
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȩ(HCHO)�׳���ȩ,��һ����Ҫ���л�ԭ�ϡ�
I.���ü״�(CH3OH)�Ʊ���ȩ
���ⷨ:CH3OH(g)=HCHO(g)+H2(g) ��H1 = +92.09kJ/mol
������:CH3OH(g) +1/2O2(g)=HCHO(g)+H2O(g) ��H2
(1)��֪:2H2(g)+O2(g)=2H2O(g) ��H3=-483.64 kJ/mol�����H2=_______��
(2)�����ⷨ���,������������ѧ�����ƽϴ���ԭ��Ϊ_______________��
(3)ͼ1Ϊ�״��Ʊ���ȩ��Ӧ��lg K(KΪƽ�ⳣ��)���¶�(T)�ı仯���ߡ�����____(�a����b��)��Ӧ���ⷨ,�ж�����Ϊ_________________��

II.��ȩ����;
(4)����ȩˮ��Һ�백ˮ����������Ƶ�������Ʒ(�ṹ��ʽ��ͼ2)����������ҽҩ�ȹ�ҵ���й㷺��;����ԭ����ȫ��Ӧ����������Ʒ,���ȩ�백�����ʵ���֮��Ϊ_______��
(5)����ȩˮ��Һ��������(NiSO4)��ϣ������ڻ�ѧ����������Ӧ��������CO2��������÷�Ӧ�����ӷ���ʽΪ____________________��
��.��ȩ�ļ��
(6)���ڼ�ȩ�����Σ�����彡����ͨ�����������Լ������м�ȩ�ĺ�����һ��ȼ�ϵ���ͼ�ȩ���崫������ԭ����ͼ3��ʾ����b���ĵ缫��ӦʽΪ_________������·��ת��4��10-4 mol����ʱ���������ڲμӷ�Ӧ��HCHOΪ_______mg��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com