
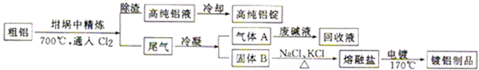
| ||
| ||


 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案科目:高中化学 来源: 题型:
| A、胶体区别于其他分散系的本质特征是分散质的微粒直径在10-9~10-7m之间 |
| B、胶体是一种比较均一、稳定的混合物 |
| C、用平行光照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同 |
| D、Al(OH)3胶体能够吸附水中悬浮的固体颗粒沉降,达到净水目的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 0.100 0mol/L的KOH标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:
0.100 0mol/L的KOH标准溶液滴定未知浓度盐酸,其操作可分解为如下几步:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将100g水倒入100g 98% 硫酸溶液中配制成49% 的硫酸溶液 |
| B、给试管里的液体加热时,液体体积不得超过试管容积的1/3 |
| C、使用胶头滴管时,应将滴管尖嘴伸进试管内,以免液体外流 |
| D、不小心将浓硫酸洒到桌面上,应先用抹布擦,再用大量水冲洗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
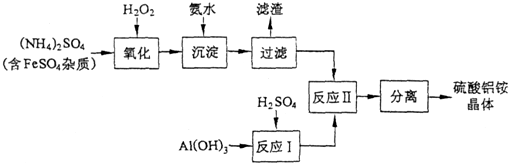
查看答案和解析>>
科目:高中化学 来源: 题型:
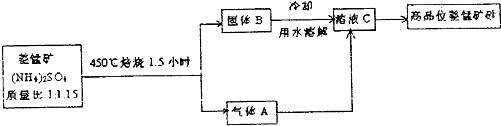
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com